Autores
Paiva de Santiago, A.C. (UFOPA) ; dos Santos Leão, M.H. (UFOPA) ; Costa dos Santos, A.M. (UFOPA) ; S. Saldanha, L. (UFPA-CAMPUS ANANINDEUA) ; Costa dos Santos, P.H. (UFPA-CAMPUS ANANINDEUA) ; Favacho, A. (UFPA-CAMPUS ANANINDEUA) ; Miranda Figueira, B.A. (UFOPA)
Resumo
Rejeitos da indústria mineral da Amazônia são gerados a partir do beneficiamento mineral que produz um subproduto com granulometria de 400 mesh e baixo teor de MnO. Neste trabalho verificou-se a possibilidade de recuperação deste material a partir de processo de fusão alcalina e lixiviação ácida. A caracterização tanto dos rejeitos, como do produto de valor agregado (MnSO4) mostrou um efetivo método de utilização dos finos de manganês como material de partida para recuperar uma importante fração de teor de Mn como produto de valor agregado, MnSO4.
Palavras chaves
Amazônia; Rejeito de Mn; Reaproveitamento
Introdução
O sulfato de manganês é um dos mais conhecidos e importantes sais de Mn, podendo ocorrer na natureza na forma hidratada (szmikita), tetrahidratada (ilesita) e heptahidratada (mallardita). Ele é um sal precursor para produção de ligas baseadas em manganês, fertilizante e diversos compostos químicos se tornando assim um reagente economicamente estratégico. Sua obtenção industrial é feita pela reação direta do dióxido de enxofre gasoso com minério de dióxido de manganês. O produto gerado é então refinado, filtrado e cristalizado para produzir sulfato de manganês(SANTOS, 2010;REIDIES, 2007). Um outro tradicional processo de obtenção do sal é feito pela biolixiviação redutiva de minério de Mn debaixo teor com solução de sulfato ferroso, acompanhado de purificação, separação, extração do solvente, eletrolise e eletro-extração (ZHANG E CHENG, 2007). O objetivo deste trabalho foi desenvolver um processo de recuperação de Mn presente nos rejeitos de oxido de Mn da indústria mineral da Amazônia através de um simples processo de fusão alcalina e lixiviação ácida com H2SO4 para produção de MnSO4 com estrutura (szmikita) .
Material e métodos
O processo de recuperação do Mn foi feito através da reação do rejeito em solução alcalina. O sobrenadante gerado foi separado por centrifugação e misturado com H2O2 para formação de MnO2 livre de impurezas, que em seguida foi lixiviado com H2SO4 em diferentes temperaturas: 60ºC, 90º e 160ºC. A caracterização mineral dos produtos foi feita por difração de raios X (DRX) foi utilizada para identificação das fases, onde se empregou um difratômetro de bancada D2Phaser (Bruker). Este equipamento possui um goniômetro de varredura vertical e um tubo de cobre (CuKa = 1.5406 Å)de 400 W de potência, com uma geometria de Bragg-Brentano no modo contínuo, velocidade de varredura de 0,25° /min,tendo como sistema de detecção um detector rápido modelo LynxEye. A tensão foi de 30 kV e 10mA, respectivamente. A caracterização morfológica do produto final foi por MEV/EDS através da sua metalização com ouro. O microscópio utilizado foi da da marca LEO-Zeiss, 430 Vp, em condições de análise utilizando imagens secundárias obtidas a 20 KV, com distância de trabalho de 11 mm.
Resultado e discussão
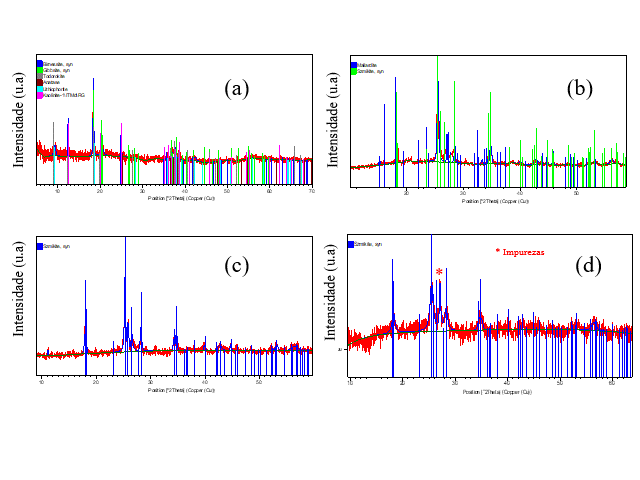
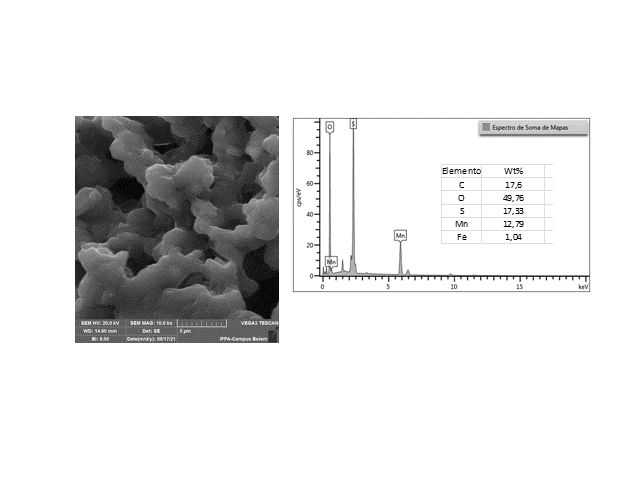
A Fig. 1 apresenta os padrões de difração de raios-X dos rejeitos (RBA) e dos produtos gerados em diferentes concentrações de H2SO4 com MnO2. Para o padrão DRX da amostra dos rejeitos(Fig. 1a), apesar da baixa definição e intensidade dos picos, foi possível identificar a presença dos minerais anatasio (PDF 01-071-1169), gibbsita (PDF 012-0460) e caulinita (PDF 029-1488), assim como de minerais de Mn como todorokita (PDF 013-0164), litioforita (PDF 041-1378) e birnessita (PDF 043-1456). É importante observar que os minerais presentes nestes rejeitos estão de acordo coma mineralogia descrita da mina do Azul nos estudos de caracterização de COSTA et al. (2005). Para os produtos de síntese,verificou-se a formação de uma mistura de sulfatos de manganês mono (PDF 033-0906) e hepta-hidratado (PDF 033-0905)quando a lixiviação foi feita a 60ºC, conforme Fig 1b. Quando a lixiviação ocorreu a 90ºC, a fase mono-hidratadacom bom grau de cristalinidade foi identificada. Em torno de 160ºC, a fase mono-hidratada também foi obtida, porém coma presença de impureza e com baixo grau de cristalinidade. A morfologia do material de partida (rejeitos) e do sulfato de Mn obtido a 90º C foi investigada por microscopia eletrônica de varredura (Fig. 2). Um morfologia com partículas dispostas aleatoriamente e sem forma definida foi observada, conforme Fig. 2a. Enquanto que para MnSO4*H2O, observou-se a formação de aglomerados bem nítidos formando uma estrutura rugosa e com tamanho médio de 5μm. A micro análise química por EDS confirmou a presença do sal de Mn através da identificação dos elementos Mn, S e O. A presença de C é proveniente do porta-
amostra.
Conclusões
De acordo com os resultados obtidos, os rejeitos de Mn da indústria mineral da Amazônia formados por anatásio , gibbsitae caulinita, todorokita, litioforita e birnessita, foram transformados com sucesso em um produto de valor agregado de grande importância tecnologia, o sulfato de manganês mono hidratado.
Agradecimentos
Os autores agradecem a CAPES, CNPQ, UFOPA, LCM (IFPA), LAMIGA (UFPA) e CETENE pelo apoio financeiro e analítico que permitiram a execução deste trabalho.
Referências
COSTA, Marcondes L. da; FERNANDEZ, Oscar J. Choque; REQUELME, Marles E. R.. O depósito de manganês do azul, Carajás: Estratigrafia, mineralogia, geoquímica e evolução geológica, Cap. V, 2005. Disponível em: http://www.adimb.com.br/site/publicacoes_amazonia/indice/Cap_V.pdf. Acesso em 2022.
REIDIES, Arno H.; WILEY, Jhon. "Manganese Compounds" Ullmann's Encyclopedia of Chemical Technology 2007. acesso em https://www.wikiwand.com/pt/Sulfato_de_mangan%C3%AAs(II)
SANTOS, JOSÉ ROBERTO DOS. Processo de produção de sulfato de manganês a partir da reação química da pirolusita, 2010. Disponível em: http://www.patentesonline.com.br/processo-de-producao-de-sulfato-de-manganes-a-partir-da-reacao-quimica-da-pirolusita-241605a.html. Acesso em 2022.
ZHANG, W.; CHENG, Y. C.. Manganese metallurgy review. Part I: Leaching ofores/ secondary materials and recovery of electrolytic/chemical manganese dioxide. Hydrometallurgy 89, p. 137-159, 2007.
















