Autores
Ramirez Chaparro, V. (UNIVERSIDAD EL BOSQUE) ; Suarez Suarez, K.R. (UNIVERSIDA NACIONAL DE COLOMBIA) ; Cortes Ortiz, W.G. (UNIVERSIDAD EL BOSQUE) ; Guerrero Fajardo, C.A. (UNIVERSIDA NACIONAL DE COLOMBIA)
Resumo
Catalizadores de vanadio y de vanadio y tungsteno soportados en óxido de silicio
empleando el método sol-gel asistido por ultrasonido fueron sintetizados. Se
emplearon técnicas como XRD, FT-IR, espectroscopía Raman, reducción a temperatura
programada (TPR) y adsorción-desorción de nitrógeno para caracterizar los
catalizadores. Los catalizadores fueron evaluados en la conversión de glucosa en
5-hidroximetilfurfural reconociendo la influencia de la sonicación y el tipo de
centro activo sobre la deshidratación del azúcar. Los materiales bimetálicos de
Vanadio y tungsteno con una carga de 2,5 % en masa sin y con sonicación
convirtieron 88,81 y 64,70 % en mol de glucosa. Lo anterior se atribuye a la
multifuncionalidad que presentan los catalizadores.
Palavras chaves
Glucosa; 5-Hidroximetlfurfural ; Catálisis heterogénea
Introdução
El 5-hidroximetilfurfural (5-HMF) es un compuesto con múltiples funciones
importantes para las industrias. Entre ellas se destaca la industria
farmacéutica, en donde se usa como plataforma para infinidad de productos y
procesos. Su uso como molécula plataforma y aplicaciones farmacéuticas se centra
principalmente en la producción del ácido L-ascórbico (L-Sorbosa) (KOWALSKI,
LUKASIEWICZ, et al., 2013), ácido levulínico, ácido fórmico, aromas, fragancias,
2,5-furfurildiamina, 2,5- furfurildiisocianato, 5-hidroximetilfurfurildienéster,
2,5-bis(hidroximetil)furano (BHMF) y 2,5-dimetilfurano (2,5-DMF), también
compuestos no furánicos como dioles, levulinato de etilo y 3-caprolactona
(HAYTON, 2020). Por otra parte, derivados del 5-HMF se han utilizado como
fármacos inhibidores de lipoxigenasa y antagonistas del receptor de histamina
H1, productos con actividad antitumoral e inhibidores antibacterianos de RNA
polimerasa, entre otros (VILLANUEVA MARTÍNEZ, 2018). El 5-HMF es considerado un
intermedio importante debido a su versatilidad y recursos potenciales de
carbohidratos, ya que de allí parte la transformación de estos para lograr su
síntesis. La síntesis de 5-HMF se ve sencilla ya que se trata de una
deshidratación del azúcar para así llegar hasta el 5-HMF, pero esta reacción es
difícil de lograr debido a que puede crear otras reacciones indeseadas llegando
hasta otros productos que no se buscan obtener. Se han reportado que al menos 37
productos pueden ser generados en esta reacción demostrando la dificultad de
llegar al compuesto que se busca obtener.
Igualmente, es de gran importancia lograr buscar métodos que sean más ecológicos
con respecto a la producción de 5-HMF, debido que al ser una deshidratación
principalmente utilizan catalizadores homogéneos que en su mayoría son ácidos
fuertes y corrosivos y estos generan efectos negativos a la salud humana y al
medio ambiente, además de ser peligrosos (PATRICIA, CÁRDENAS, 2017). Sin
embargo, se encuentran los catalizadores heterogéneos que juegan un papel muy
importante en la reacción y así mismo en los resultados de rendimiento y
selectividad a 5-HMF, y por otro lado en la conversión de glucosa. Estos
catalizadores además de promover la deshidratación de glucosa son amigables con
el medio ambiente y se pueden reciclar para así volver a ser utilizados. Varios
autores destacan la utilización de metales de transición soportados como
catalizadores heterogéneos de gran eficacia entre ellos: Molibdeno (Mo),
Tungsteno (W), Hierro (Fe) y Vanadio (V).
La manera convencional en la cual se obtiene 5HMF es a partir de fructosa por
sus buenos resultados, pero el problema de este es que no se puede llegar a una
producción a gran escala por su elevado costo de materia prima. También se usan
normalmente catalizadores homogéneos para la obtención del 5HMF llegando altos
rendimientos a 5HMF, no obstante estos conllevan a varios problemas como lo son:
costos altos, corrosión del material, difícil separación y contaminación
ambiental por gases y a la hora de reciclarlos (PALACIOS, 2017). Debido a esta
problemática, con este proyecto se buscó direccionar la obtención de 5HMF con
catálisis heterogénea ya que esta se puede emplear con procesos más sencillos y
mejores para el medio ambiente. Se destaca que los ácidos sólidos necesitan
sitios catalíticos que sean estables térmicamente para la conversión de glucosa
a 5-HMF.
Material e métodos
Para realizar la síntesis de los materiales por el proceso sol-gel se definió
como variables experimentales: i) Carga de 5,0 % en masa de los componentes (es
decir, V o W); y ii) el uso de sonicación durante la síntesis, con el fin de
reconocer la influencia de esta variable en las propiedades físicas y químicas
de los catalizadores, manteniendo constante la temperatura de calcinación (750
ºC). Los materiales catalíticos fueron caracterizados por XRD usando un
difractómetro Panalytical X'Pert Pro MPD con ánodo de Cu de longitud de onda Kα=
1,54060 Å, voltaje 45 kV. Los datos fueron recolectados a temperatura ambiente
entre 10 ° y 90 ° con geometría 2θ, la identificación de fases se realizó usando
el programa X´Pert highScore Plus 2.2. Los espectros infrarrojos (FTIR) se
registraron en un espectrofotómetro Nicolet FTIR iS10, en el rango espectral de
4000– 600 cm-1. Los espectros de transmisión se obtuvieron de las muestras
diluidas con KBr, preparando la tableta con de 1,0 mg de la muestra sólida y 200
mg de KBr puro. Todos los espectros se registraron a una resolución de 1 cm-1.
Los espectros Raman se obtuvieron usando el microscopio Thermo Scientific Raman
con excitación de 532 nm de un láser de diodo a través de un objetivo × 10 y
nivel de potencia de laser de 8.0 mW. La radiación dispersada de la muestra se
recolectó en ángulo recto con el rayo láser y se dirigió a un detector con una
matriz de fotodiodos de refrigeración termoeléctrica a -50 ° C.
Análisis de reducción a temperatura programada (TPR) se realizaron empleando un
equipo QUANTACHROME modelo 3000 equipado con un detector de conductividad
térmica. Se dispusieron 120 mg de la muestra en polvo previamente tamizada la
cual fue desgasificada en corriente de Ar a 320 ºC durante 1h. La reducción se
llevó a cabo con una corriente compuesta por 10 % v/v H2/Ar a 30 cm3/min bajo
una rampa lineal de calentamiento de 10 ºC/min hasta los 1000 ºC.
Por otra parte, para el análisis de sortometría de nitrógeno se pesaron
aproximadamente 100 mg del sólido y se llevó a cabo una desgasificación a 413 K
durante 10 h bajo atmósfera de He. Posteriormente, se llevó a cabo la isoterma
de adsorción y desorción de N2 a 77 K en el rango de presiones relativas (P/Pº)
de 10-4 hasta 1 haciendo uso de un equipo de marca MICROMERITICS modelo ASAP
2020. La actividad catalítica de los materiales fue evaluada en un reactor de
acero inoxidable con atmosfera de nitrógeno el cual fue diseñado y elaborado al
interior del grupo de investigación. En un ensayo típico se colocan 300 mg de
glucosa, 100 mL de agua y 100 mg de catalizador al interior del reactor.
Posteriormente, se realizan tres purgas con nitrógeno para desplazar el aire, se
presuriza el sistema y se programa la temperatura de reacción. Finalmente, se
enfría el reactor y el producto resultante se cuantifica por cromatografía
líquida de alta eficiencia.
Resultado e discussão
Los patrones de XRD de los materiales sintetizados por el método Sol Gel en
función de agitación mecánica o ultrasonido mecánico para los precursores de
vanadio y de vanadio- tungsteno se muestran en la figura 1.
En la figura 1, se presentan los difractogramas de rayos X de las muestras
preparadas por el método sol-gel. Es importante destacar que la secuencia de
formación de estructuras cristalinas de sílice sigue el siguiente orden de
acuerdo con la temperatura a la cual se lleve el proceso.
cuarzo 860 °C→ tridimita 1470 °C→ cristobalita
Así mismo, se debe mencionar que existen dos formas de cuarzo según la
estructura: i) α-cuarzo y ii) β-cuarzo. El primero se clasifica dentro del
sistema cristalino como trigonal y existe hasta temperaturas de alrededor de 570
°C, por encima de esta temperatura se transforma en β-cuarzo que presenta una
estructura hexagonal. A temperaturas superiores de 860 °C el β-cuarzo se
transforma en tridimita, otro mineral de sílice De esta manera, los materiales
calcinados a 750 °C presentan la estructura de β-cuarzo.
En cuanto a los materiales con vanadio (V/SiO2), además de la banda ancha
asociada a la sílice amorfa, presentaron dos pico alrededor de 2Ɵ = 26 y 50°
atribuido al V2O5 (SERRATO RODRÍGUEZ, RUIZ MARINES, 2017), (SORIANO, VIDAL-MOYA,
et al., 2016). Finalmente, los materiales con tungsteno presentan una serie de
picos alrededor de 2Ɵ = 23, y 24° atribuidos a los óxidos formados (WIESFELD,
GAQUERE, et al., 2019).
Actividad catalítica
Los resultados de actividad de los materiales catalíticos de vanadio y de
vanadio-tungsteno se presentan en la figura 2. Los valores de conversión de
glucosa son superiores al 81,48 % en mol para los catalizadores y sus
respectivas temperaturas de reacción, confirmando así su alta actividad. Lo
anterior se atribuye a la disponibilidad de centros activos de vanadio y de
tungsteno o los dos que permiten activar la molécula de glucosa para su
posterior transformación. De la misma manera, es importante destacar la
importancia que puede tener los oxígenos del soporte de sílice y los grupos
silanol, en el proceso de activación del azúcar (CORTÉS-ORTIZ, BAENA-NOVOA, et
al., 2019).
En cuanto a la selectividad a 5-hidroximetilfurfural se destaca que los valores
más altos se observan cuando la temperatura implementada es 180°C, en cuanto a
vanadio 25,28 y a Vanadio-tungsteno 13,51 % en mol. Al respecto, se puede
afirmar que los catalizadores cuentan con sitios ácidos de Lewis procedentes del
metal de transición y sitios que actúan cómo ácidos de Brönsted procedentes de
los grupos silanol (Si-OH) del soporte. De esta manera, el mecanismo de reacción
general puede direccionarse en dos etapas: i) Los sitios ácidos de Lewis
interviene en la isomerización de glucosa a frutosa y ii) los sitios ácidos de
Brönsted interviene en la deshidratación de la fructosa hasta 5-
hidroximetilfurfural.
Lo anterior se puede confirmar al comparar los difractogramas de los soportes de
sílice, en donde se observa que el uso de sonicación genera una disminución de
especies silanol. Dicha disminución genera una menor selectividad, toda vez que,
si bien el vanadio promueve la isomerización es el soporte quién contribuiría
con la reacción de deshidratación. Al haber menor cantidad de grupos silanol que
actúen como ácido de Brönsted, baja la selectividad.
Por otra parte, los materiales de con tungsteno presentan las menores
selectividades 13,51 y 0,24 % en mol. Al respecto, a pesar de que la conversión
de glucosa presenta valores altos 88,81 y 64,70 % en mol, debido al rol del
tungsteno como ácido de Lewis, los valores de selectividad son bajos por la
ausencia de sitios ácidos de Brönsted que promuevan la formación de 5-
hidroximetilfurfural a partir de la fructosa, evidenciando como la temperatura
influye en estas variables.
Finalmente, con los materiales bimetálicos se observa un incremento en la
conversión con respecto al tungsteno. En este caso, además de la presencia de
sitios ácidos de Lewis y Brönsted, la cooperación fases y la multifuncionalidad
de los materiales juegan un rol importante para favorecer la isomerización de la
fructosa (GRASSELLI, 2003).
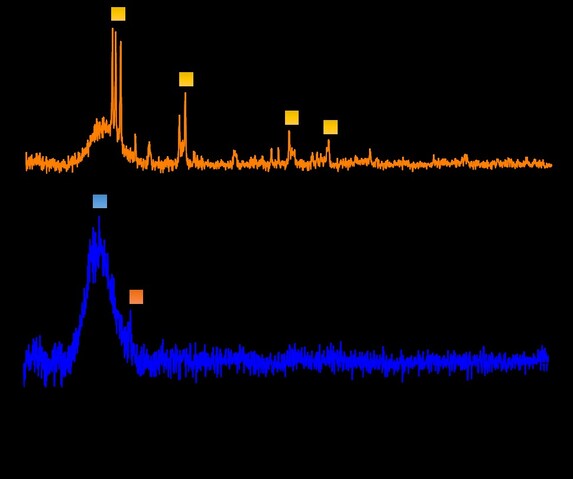
Difractograma de las muestras de vanadio y de Vanadio-tungsteno preparadas por el método sol-gel
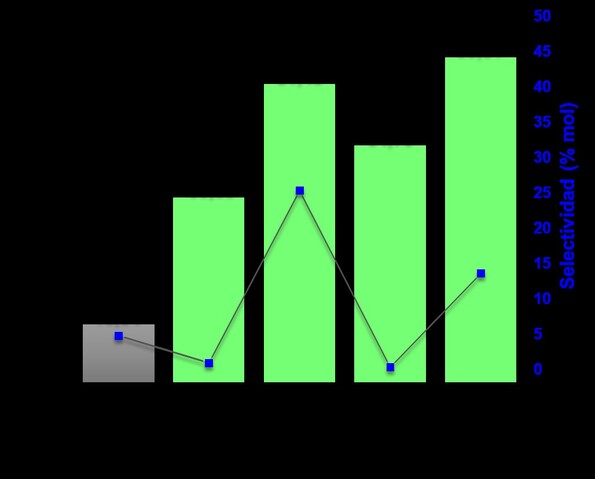
Conversión de glucosa y selectividad a 5- hidroximetilfurfural empleando V/SiO2 -140, V/SiO2-180, VW/SiO2-140, VW/SiO2-180 y sin catalizador
Conclusões
Se sintetizaron materiales catalíticos de vanadio y de vanadio-tungsteno
soportados en óxido de silicio modificando el proceso de agitación durante la
formación del gel. Por una parte, se empleó agitación mecánica y por otro lado
ultrasonido. Se evidencia que el uso de ultrasonido modifica la organización
molecular que se genere en los materiales catalíticos lo cual se comprueba por los
resultados de caracterización.
Los materiales de vanadio soportado en óxido de silicio calcinados a 180 °C
presentan mayor selectividad hacia 5-hidroximetilfurfural. Lo anterior se atribuye
a la multifuncionalidad que presentan los catalizadores. El vanadio actúa cómo
ácido de Lewis generando la isomerización de la glucosa a fructosa y los grupos
silanol del soporte actúan cómo ácidos de Brönsted promoviendo la deshidratación
del monosacárido y formación de 5-hidroximetilfurfural.
Agradecimentos
Los autores agradecen al Departamento de Química de la Universidad Nacional de
Colombia y al Departamento de Química y Programa de Química Farmacéutica de la
Universidad El Bosque.
Referências
CORTÉS-ORTIZ, W. G., BAENA-NOVOA, A., GUERRERO-FAJARDO, C. A. "Structuring-agent role in physical and chemical properties of Mo/SiO 2 catalysts by sol-gel method", Journal of Sol-Gel Science and Technology, v. 89, n. 2, p. 416–425, 2019. DOI: 10.1007/s10971-018-4892-7. .
GRASSELLI, R. K. "Fundamental Principles of Selective Heterogeneous Oxidation Catalysis.", ChemInform, v. 34, n. 20, p. 79–88, 2003. DOI: 10.1002/chin.200320276. .
GUO, F., FANG, Z., ZHOU, T. J. "Conversion of fructose and glucose into 5-hydroxymethylfurfural with lignin-derived carbonaceous catalyst under microwave irradiation in dimethyl sulfoxide-ionic liquid mixtures", Bioresource Technology, v. 112, p. 313–318, 2012. DOI: 10.1016/j.biortech.2012.02.108. .
HAYTON, J. Recent advances in development of platform chemicals. [S.l.], Elservier, 2020.
KOWALSKI, S., LUKASIEWICZ, M., DUDA-CHODAK, A., et al. "5-hydroxymethyl-2-furfural (HMF) -heat-induced formation, occurrence in food and biotransformation - A review", Polish Journal of Food and Nutrition Sciences, v. 63, n. 4, p. 207–225, 2013. DOI: 10.2478/v10222-012-0082-4. .
PALACIOS, E. X. A. "Estudio de sistemas bifuncionales para la obtención de 5 hidroximetilfurfural", 2017. .
PATRICIA, V., CÁRDENAS, L. SUSTAINABLE CHEMISTRY FOR THE SYNTHESIS OF FURANIC COMPOUND. Investigación Joven. [S.l: s.n.], 2017.
SERRATO RODRÍGUEZ, J., RUIZ MARINES, A. "Síntesis y caracterización de catalizadores bifuncionales del tipo Sn-SBA-15 para la generación de 5-hidroximetilfurfural a partir de glucosa", Mundo Nano. Revista Interdisciplinaria en Nanociencia y Nanotecnología, v. 9, n. 17, p. 49, 2017. DOI: 10.22201/ceiich.24485691e.2016.17.58151. .
SORIANO, M. D., VIDAL-MOYA, A., RODRÍGUEZ-CASTELLÓN, E., et al. "Partial oxidation of hydrogen sulfide to sulfur over vanadium oxides bronzes", Catalysis Today, v. 259, p. 237–244, 2016. DOI: 10.1016/j.cattod.2015.08.009. .
VILLANUEVA MARTÍNEZ, N. I. Obtención De 5-Hidroxmetilfurfural a Partir De Glucosa Proveniente De Licores De Corteza De Pino Y Eucalipto, Utilizando Catalizadores Sólidos En Medio Acuoso. 2018. 1–106 f. Universidad de Concepción, 2018.
WIESFELD, J. J., GAQUERE, R., HENSEN, E. J. M. "Mesoporous Doped Tungsten Oxide for Glucose Dehydration to 5-Hydroxymethylfurfural", ACS Sustainable Chemistry and Engineering, v. 7, n. 8, p. 7552–7562, 2019. DOI: 10.1021/acssuschemeng.8b05684. .
















