Autores
Soares Ferreira, P. (INSTITUTO FEDERAL DE BRASÍLIA) ; Simenremis Pereira, N. (INSTITUTO FEDERAL DE BRASÍLIA)
Resumo
As aulas experimentais são uma das estratégias na contextualização do ensino.
Portanto, este trabalho tem como objetivo a possibilidade de construção de um
roteiro experimental simples que poderá ser realizado na disciplina de
laboratório de análise instrumental para o curso de licenciatura em química ou
técnico em química onde permite a avaliação qualitativa e quantitativa de
paracetamol (PCM) em formulações farmacêuticas contendo cafeína, através da
técnica de cromatografia líquida de alta eficiência. As separações
cromatográficas foram feitas em uma coluna NST 18 100Å, 200 mm x 4,6mm x 10μm),
usando fase móvel metanol e água (40:60, v/v), em modo de eluição isocrático com
o fluxo 1 mL/min e detecção ultravioleta em 264 nm. Tendo como resultado 491,32
mg de uma formulação de 500 mg PCM.
Palavras chaves
Roteiro Experimental; HPLC; Ensino de química
Introdução
Sabe-se que de acordo com as Diretrizes Curriculares para o Ensino
Superior de Química, os currículos da atualidade foram feitos com o intuito de
contemplar as demandas dos alunos para que haja uma formação profissional
consciente das necessidades que o mercado apresenta e o torne especializado nas
subáreas de atuação no qual ele tem interesse (BRASIL, 2001). Aprovado em
06/11/2011, o parecer Nº 303/2001 que relata as diretrizes para os cursos de
Química (bacharelado e licenciatura plena) estabelece que os licenciandos em
química precisam ter uma formação sólida, geral e abrangente no que diz respeito
aos campos da Química, além de possuir conhecimento das técnicas para utilização
de laboratórios. Ainda, segundo o documento, o licenciado em Química deve ter a
habilidade para trabalhar em laboratórios de química e utilizar seus
conhecimentos em experimentação como recurso didático (BRASIL, 2001).
De uma forma geral, o processo de ensino-aprendizagem em química não é
uma tarefa simples, pois, por um lado, o ensino da química muitas vezes é
retratado pelos alunos, tanto do Ensino Superior quanto do Médio, como algo
desinteressante, sem sentido e que exige esforço de memória (MORTIMER, 1999) e,
por outro, tem-se a necessidade de fazer com que o ensino da ciências seja
interessante para os estudantes. Para isso, é vital que o processo de ensino-
aprendizagem seja o mais interdisciplinar possível, interligando assuntos que
estejam presentes na realidade do aluno com o meio social onde ele está
inserido. Para resolver essas questões, o docente precisa assumir o papel de
mediador do ensino e não mais do detentor de todo o saber, desenvolvendo no
aluno a capacidade de tomada de decisões (SANTOS e SCHNETZLER, 1996). É
importante que o professor consiga interligar o conhecimento científico com o
conhecimento prévio do aluno, seja por meio de discussões, observações, tendo
como consequência uma maior interação entre os alunos e motivando-os a buscar
razões e explicações para os fenômenos que acontecem à sua volta. Um dos meios
de motivação e de estratégia eficiente na contextualização do ensino e no
desenvolvimento de um aluno interessado são as aulas experimentais no meio
escolar que apresentam diversas funções, tais como: a de ilustrar um princípio,
desenvolver atividades práticas, testar hipóteses ou propor métodos até mesmo de
cunho investigativo (IZQUIERDO E COLS, 1999). Muitas dessas aulas são realizadas
na educação básica com roteiros em ambiente apropriados para laboratório ou de
forma demonstrativa (MASSENA; GUZZI FILHO; SÁ, 2013).
A experimentação no ensino de Química (seja no ensino superior ou médio)
torna-se um elo que pode convergir dois pontos desafiadores no processo de
ensino: (1) o de tornar as aulas mais interessantes e motivadoras; (2) o de
propor uma formação de qualidade para os profissionais de química. Portanto, as
atividades experimentais devem fazer parte do processo de ensino, pois elas
permitem discutir, buscar resultados, formular hipóteses, estimular o senso
crítico, desenvolver motivação e aptidão interdisciplinar (DOMINGUES, 2018). A
atividade prática possibilita aos estudantes o contato com fenômenos químicos,
permitindo a este a construção de seus próprios conhecimentos por meio de suas
observações, lógicas e linguagens (SANTOS; MARQUES; SANTOS, 2010).
Os experimentos utilizados no processo de ensino permitem observações
dos efeitos macroscópicos e são essenciais no entendimento e na aprendizagem dos
conceitos químicos (FROZZA, E.; PASTORIZAI, B. S, 2021). Tais práticas
experimentais não devem ser utilizadas de formas isoladas, mas juntamente com as
disciplinas teóricas para que os discentes possam compreender melhor os
conceitos e fenômenos de química, articulando a compreensão do macroscópico, e
submicroscópico e o simbólico (JOHNSTONE 1982, APUD FROZZA, 2021).
Considerando a discussão acima, este presente trabalho tem como
objetivo discutir a possibilidade de construção de um roteiro experimental
simples que poderá ser aplicado na disciplina de laboratório de análise
instrumental para o curso de licenciatura em química ou técnico em química. Esta
prática de laboratório permite a avaliação qualitativa e quantitativa de
paracetamol em formulações farmacêuticas contendo cafeína, utilizando a técnica
de cromatografia líquida de alta eficiência (CLAE). Ao se pensar na
contextualização desta aula, o docente poderá abordar assunto de áreas como
Química Orgânica, Química Análitica e Bioquímica, além de ser possível
interligar o conteúdo teórico e prático com o cotidiano dos alunos, pois tanto a
indústria farmacêutica quanto seus produtos fazem parte do dia a dia da
sociedade.
Material e métodos
2.1. Materiais utilizados
10 tabletes de tylenol dc, paracetamol (padrão), metanol (fase móvel),
água mili-Q (fase móvel), espátula, vidro de relógio, almofariz e pistilo, 12
balões volumétricos de 25 mL, 2 Balão volumétrico de 100 mL, filtro de membrana
Millipore de tamanho de poro de um 0,45 μm, seringa.
2.2. Preparação das soluções padrão de cafeína e paracetamol
Pesar 0,01 g do padrão de cafeína (CF) e 0,06 g de paracetamol (PCM) em
uma balança analítica, em seguida transferir para os seus respectivos balões
volumétricos de 100 mL. Adicionar 70 mL da fase móvel (água/metanol 80:20 v/v) e
deixar agitando durante 1h. Levar as soluções para o banho ultrassônico para a
melhor dissolução das drogas por 15 min. Após esse período, completar até o
menisco dos balões com a fase móvel. Obtendo, dessa forma duas soluções com
concentrações correspondentes a 600 µg/mL de paracetamol e 100 µg/mL de cafeína.
A partir da solução estoque de paracetamol, preparar, por meio de
diluições, sete soluções com concentrações na faixa de 15–240 μg/mL para
obtenção da curva de calibração. Prepare uma solução de cafeína 40 ppm a partir
da solução estoque de 100 µg/mL de cafeína. Filtre todas as soluções com um
filtro de membrana Millipore de tamanho de poro de um 0,45 μm utilizando uma
seringa. Desgaseificar todas as todas as amostras utilizando o banho
ultrassônico.
2.3 Preparação da amostra
Triturar 10 tabletes de comprimido de tylenol dc até obter um pó fino e
homogêneo que contém 5000 mg de PCM e 650 mg de CF. Logo em seguida, transferir
a amostra para um balão volumétrico de 100 mL e adicionar 70 mL da fase móvel
(água/metanol) 80:20 v/v. Deixar agitar por 1h e em seguida levar até o banho
ultrassônico por 15 min para a completa extração das drogas. Completar o menisco
com a fase móvel. Após esse procedimento, realizou-se duas diluições, ambas em
balão de 50 mL. Na primeira diluição, pipete 5 mL da solução da amostra obtida
anteriormente. Já na segunda diluição, pipete 125 μg/mL da alíquota anterior e
em seguida dissolva na fase móvel (água:metanol) 80:20, para obter, por fim,
concentração de 5 μg/mL de paracetamol e 0,65 μg/mL de cafeína.
Em seguida, filtre a amostra em um filtro de membrana Millipore de
tamanho de poro de um 0,45 μm utilizando uma seringa e reserve para posterior
injeção de 20 µL no HPLC. Desgaseificar todas as amostras utilizando o banho
ultrassônico.
2.4 Condições cromatográficas
A coluna cromatográfica de fase reversa C18 - modelo: NST 18 100Å, 200
mm x 4,6mm x 10μm em uma taxa de fluxo de 1mL/min e injeção de volume de 20 μl.
O sistema aplicado foi no modo isocrático e a temperatura da coluna foi mantida
na temperatura ambiente, enquanto a detecção de UV foi definida em 264 nm.
Resultado e discussão
Visando verificar a separação do paracetamol na formulação farmacêutica
analisada e determinar quantitativamente a respectiva concentração de princípio
ativo presente no medicamento, injetou-se 20 μL dos padrões de paracetamol com o
fluxo de metanol-água (20:80 v/v) e taxa de fluxo de 1 mL/min. Posteriormente ao
tempo de espera para cada corrida, 15 minutos, foi possível obter os
cromatogramas para as soluções padrão de paracetamol e da amostra de tylenol dc,
em que são relacionados o tempo de retenção (min) em função da intensidade da
absorbância (mAU). Os resultados estão apresentados nas figuras 1 e 2 dispostas
a seguir.
A Figura 1a e Figura 1b mostram os cromatogramas das soluções padrão de
paracetamol 240 ppm e cafeína 40 ppm. O paracetamol apresentou um tempo de
retenção igual a 3,941 minutos enquanto que a cafeína apresentou o tempo de
retenção em 6,583 minutos. Esse tempo de retenção se refere a utilização da fase
móvel água- metanol (80:20 v/v) e taxa de fluxo de 1,0 mL/min. No entanto, ao
alterar a fase móvel para 60:40 (água:metanol) com fluxo de 0,8 mL/min e o
tempo de retenção foi alterado conforme pode ser visto na Figura 1c e 1d. É
possível verificar que, nestas condições, o tempo de retenção do paracetamol e
cafeína foi de 4,397 minutos e 5,583 minutos respectivamente. A Figura 1e mostra
o cromatograma da amostra de medicamento obtido nas mesmas condições
cromatográficas dos padrões das figuras 1c e 1d (fase móvel água/metanol (60:40
v/v) com fluxo de 0,8 mL/min). Observe que a resolução dos picos não é a ideal,
pois a separação do paracetamol da cafeína não foi completa. Uma melhor
resolução dos picos foi obtida com a fase móvel água/metanol (80:20 v/v) com
fluxo de 1 mL/min como pode ser visualizado na Figura 2.
A Figura 2a mostra o cromatograma da formulação farmacêutica estudada.
Observe que o tempo de retenção do paracetamol e cafeína na amostra é 3,946 min
e 6,567 minutos, respectivamente. Esses tempos de retenção são os mesmos
apresentados pelas soluções padrão de paracetamol e cafeína obtidos nas mesmas
condições cromatográficas da amostra (Figura 1a e 1b), confirmando a composição
do medicamento.
É possível verificar também que ao utilizar a fase móvel água/metanol (80:20
v/v) com fluxo de 1mL/min, obteve-se uma melhor resolução dos picos do
cromatograma quando comparado com o cromatograma obtido com a fase móvel
água/metanol (60:40 v/v) com fluxo de 0,8 mL/min (Figura 1e) . A Figura 2b
mostra a curva de calibração construída a partir das soluções padrão de
paracetamol cuja concentrações variam de 15–240 ppm. A equação que representa a
curva de calibração equivalente a f(x) = 35121,2x+156648 e possui um valor de
R2 igual a 0,99484, o que mostra uma boa linearidade. Após a extração com
solvente, diluição adequada e análise, a amostra de medicamento apresentou um
quantidade de paracetamol equivalente a 491,32 mg, o que corresponde a 98,2% do
princípio ativo presente na formulação.
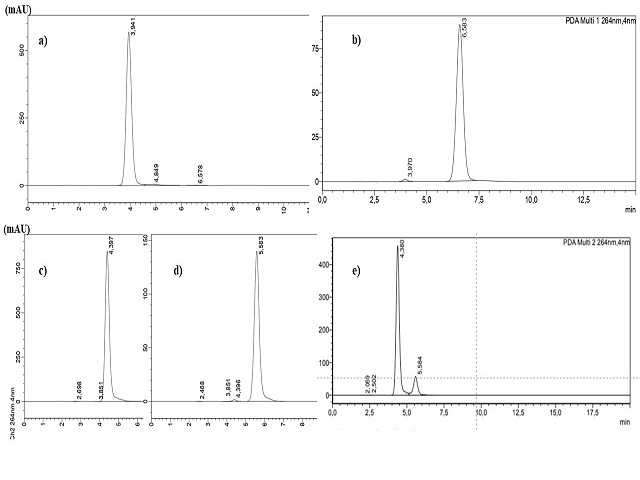
a e b)solução PCM e CF com fase móvel 80:20 v/v;c e d)solução de PCM e CF com fase móvel 60:40 v/v;e)amostra de medicamento com fase móvel 60:40 v/v
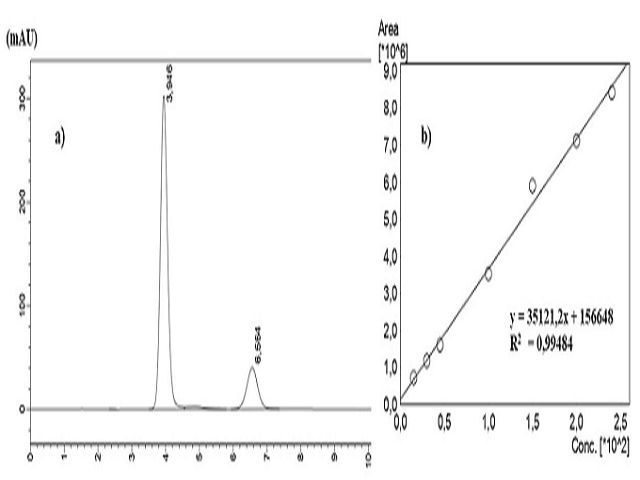
a)Cromatograma da amostra de Tylenol dc com a fase móvel (80:20 v/v) e fluxo 1 mL/min;b)curva de calibração do paracetamol obtida nas mesmas condições
Conclusões
A quantidade de paracetamol encontrada em um comprimido de Tylenol dc foi de 491
mg, o que corresponde a 98,2% do princípio ativo no comprimido. Isso mostra que o
método possui uma boa especificidade, rapidez e simplicidade. Apesar de não
validado, é possível seguir esta metodologia como um roteiro experimental para
aula de laboratório de análise instrumental. Este roteiro permite abordar
conteúdos de três áreas da Química: orgânica, análise instrumental e bioquímica,
além de permitir a contextualização do conteúdo com o dia a dia do aluno. Cabe ao
docente analisar se é possível fazer a análise qualitativa e quantitativa em uma
única aula ou se divide em dois momentos distintos a fim de explorar ao máximo os
conceitos e conteúdos que podem ser abordados nesta prática.
Agradecimentos
Os autores agradecem à Fundação de Apoio à Pesquisa do Distrito Federal (FAPDF) e
ao Instituto Federal de Brasília (IFB) pelo suporte financeiro.
Referências
BRASIL. Ministério da Educação. Diretrizes Curriculares Nacionais para os Cursos de Química, Brasília, 2001. Disponível em: http://portal.mec.gov.br/cne/arquivos/pdf/CES1303.pdf < Acesso em: 30 de agosto de 2022.>
DOMINGUES, Lucas Fernandes. Teoria e Prática na Formação Profissional do Técnico em Química. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 03, Ed. 05, Vol. 03, pp. 116-130, Maio de 2018. ISSN:2448-0959
FROZZA, E.; PASTORIZAI, B. S. “A Química é uma área experimental!”: discursos sobre a experimentação em um curso. Ciência e Natura, Santa Maria, v. 43, e5, p. 1-26, 2021. DOI 10.5902/2179460X43465. Available at: https://doi.org/10.5902/2179460X43465)
IZQUIERDO, M.; SANMARTÍ, N. e ESPINET, M. Fundamentación y diseño de las prácticas escolares de ciencias experimentales. Enseñanza de las Ciencias, v. 17, n. 1, p. 45-60, 1999
JOHNSTONE, A. H, Macro and micro-chemistry. School Science Review, Hatfield, UK, v. 64, n. 227, p. 377-379, 1982.
MASSENA, ELISA PRESTES, GUZZI FILHO, NEURIVALDO JOSÉ DE E SÁ, LUCIANA PASSOS, Produção de casos para o ensino de Química: uma experiência na formação inicial de professores. Química Nova. 2013, v. 36, n. 7, pp. 1066-1072.
MORTIMER, EDUARDO FLEURY, MACHADO, ANDRÉA HORTA E ROMANELLI, LILAVATE IZAPOVITZ, A proposta curricular de química do Estado de Minas Gerais: fundamentos e pressupostos. Química Nova. 2000, v. 23, n. 2, pp. 273-283.
SANTOS, W.F.; MARQUES, D.I.D.; SANTOS, M.S.F. Formação continuada de professores de química: práticas experimentais e jogos lúdicos como alternativa metodológica. In: ENCONTRO DE EXTENSÃO DA UFPB, 12., 2010. Anais... Bananeiras: UFPB, 2010.
SANTOS, W. L. P.; SCHNETZLER, R. P. Função Social: o que significa ensino de química para formar cidadão? Química Nova na Escola, n.4, nov. 1996.
















