Autores
Santos, H.C. (UFAM) ; Lima, M.P. (INPA) ; Catanhede, C. (INPA) ; Nogueira, P.A.D. (UFAM) ; Souza, P.B.A. (UFAM) ; Ramos, H.G. (UFAM) ; Lima, J.A.O. (UFAM) ; Oliveira, D.S. (UFAM) ; Oliveira, M.V.S. (UFAM)
Resumo
Estudos fitoquímicos com resíduos madeireiros de Swietenia macrophylla King.
proporcionaram três novos limonóides com esqueleto fragmalina, juntamente com três
triterpeno conhecidos cicloeucalenol (1), α e β-amirina (2 e 3). As substâncias
tiveram suas estruturas propostas a partir de análises por espectroscopia de
Ressonância Magnética Nuclear (RMN) 1D e 2D, Espectro de Massas de Alta e baixa
Resolução e por comparação com dados da literatura. Considerando o potencial
biológico das classes das substâncias isoladas, foi realizado o ensaio inseticida
frente às ninfas de Bemesia tabaci (Mosca branca) e os limonóides com esqueleto
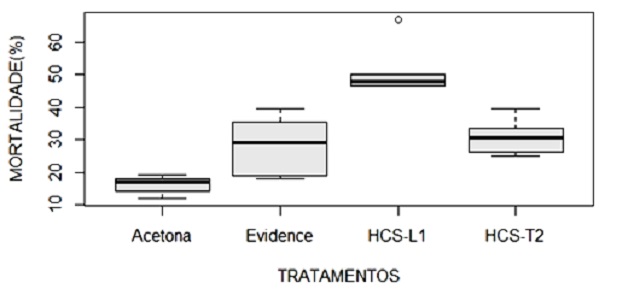
fragmalina destacaram-se com 53,55% de mortalidade.
Palavras chaves
Meliaceae; Fitoquímica; RMN
Introdução
Do ponto de vista químico, as plantas da família Meliaceae são caracterizadas
pela predominância de limonóides que são triterpenos altamente oxigenados,
também conhecidos na literatura como tetranorterpenoides (ROY e SARAF, 2006;
TAYLOR, 1984). Os limonóides são conhecidos pelo alto potencial biológico,
especialmente a atividade inseticida (CHAMPAGNE, 1992). A espécie Swietenia
macrophylla King. (mogno) no passado foi fortemente explorado devido ao alto
valor comercial atribuído à sua madeira, mas atualmente é uma espécie protegida
por lei e tem alarmado grupos ambientalistas preocupados com sua extinção
(CHIMELI, 2010). Como esta espécie pertence a um ecossistema ameaçado e os
estudos com madeira são bastante escassos na literatura, surgiu a oportunidade
de realizar estudos fitoquímicos com madeira de mogno a partir da janela de um
prédio abandonado com mais de 30 anos. A proposta de aliar as investigações
fitoquímicas com as atividades inseticida com Bemisia tabaci (Mosca branca) é
devido ao interesse por substâncias ativas, visto que, cada vez mais vem
crescendo os problemas relacionados à resistência dos insetos aos produtos
comerciais disponíveis.
Material e métodos
A extração e isolamento dos compostos foram realizados no Laboratório de Química
de Produtos Naturais do INPA, onde inicialmente os resíduos madeireiros foram
pulverizados em moinho de facas do tipo Willey e por conseguinte, submetidos à
extração a frio com hexano e metanol, por 7 dias cada. Foram utilizadas técnicas
de cromatografia clássica em coluna aberta (CC), com diferentes fases
estacionárias (celulose, sephadex LH-20, florisil 60-100 mesh, sílica gel 70-230
e 230-400 mesh) e cromatoplacas preparativas de sílica gel 60 (merck), para
fracionar os extratos e obter metabólitos secundários. Os espectros de
ressonância magnética nuclear (RMN) foram registrados em solvente deuterado à
temperatura ambiente em um Bruker Biospin, modelo Fourier (300 MHz - 1H e 75 MHz
- 13C). Os dados de espectrometria de massa foram adquiridos em
espectrofotômetro da marca Bruker Daltonics, modelo MicrOTOF-QII com analisador
Time-of-flight de alta resolução e fonte de ionização eletrospray- ESI. Nos
ensaios biológicos ninficidas com Bemisa tabaci (mosca branca), uma Torre de
Potter Burkard scientific®, foi usada para aplicação de 1 mg.mL-1 de
substância/folha de forma homogênea.
Resultado e discussão
O extrato hexânico fracionado em coluna de sílica gel 60, forneceu 22 frações. O
resultado desse procedimento resultou na fração 15, contendo o isolado 1
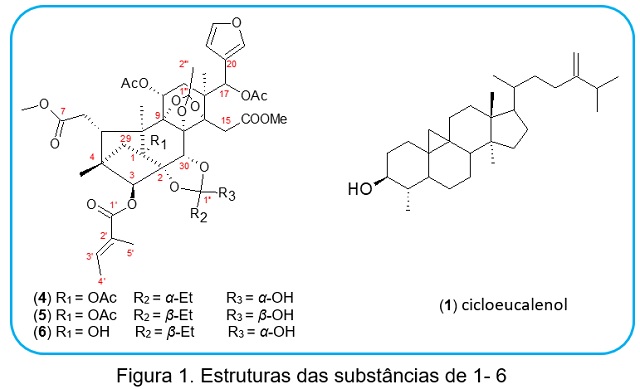
(cicloeucalenol) e nas subfrações 9 e 22 que foram refracionadas. A subfração 9
forneceu os compostos 2 e 3 (α e β-amirina), após introduzida em coluna de
celulose. Já a 22 foi recromatografada em sílica flash, resultando em 14
subfrações, a 5 foi submetida em placa preparativa (CCDP), resultando nos
compostos 4 e 5. O extrato metanólico fracionado em de sílica gel 60, forneceu
38 frações. A subfração 3 passou por sucessivos fracionamentos (florisil®,
Sephadex LH-20) e CCDP para obter o composto 6.
As análises de RMN 1D e 2D de 4, 5 e 6 revelaram similaridade nos espectros e
apontaram para limonóides com esqueleto do tipo fragmalina, com anel D-seco
aberto e com dois grupos ortoésteres. Os dados de 1H-NMR de 4, 5 e 6 exibiram
sinais de anel β-furil (δ 6,6-7,8), grupos metoxi (δ 3,1-3,6), acetoxis (δ 1,9-
2,5) e oximetínicos (δ 4,97-6,1). Um grupo tigloil foi verificado em C-3 δ 7,1
(H-3’); 1,9 (H-4’) e 1,7 (H-5’) e dois ortoéster foram observados em δ 119,0-
119,1 (C-1’’’) e 122,6-124,4 (C-1”). A presença da ponte (4-29-1) no anel A,
característico em limonóides fragmalina, foi evidenciada no HMBC a 3JHC de δ
0,9-0,8 (H-28) com o carbono metilênico em δ 39,4-39,2 (C-29). O conjunto de
analises de RMN, massas e dados da literatura (SAAD et al. 2003), permitiram
encontrar as diferenças espectrais no substituinte em 2,30-ortoéster, resultando
na elucidação dos novos limonóides (4), (5) e (6) (figura 1). Nos ensaios
inseticidas de 1, 4 e 5, os limonóides fragmalinas exibiram atividade de
mortalidade de 53,55%, enquanto que o triterpeno 1 mostrou 30,2%, ambos
superiores ao produto Evidence WG700 com 28,3% (Figura. 2).
Conclusões
Os estudos fitoquímicos trouxeram informações do perfil químico de substâncias sem
relatos prévios na literatura para madeira de S. macrophylla, com 3 novos
limonóides do tipo fragmalina, com anel D-seco aberto e com dois grupos
ortoésteres e também de triterpenos conhecidos como, cicloeucalenol, α e β-
amirina. Nos ensaios inseticidas, os limonóides e o triterpeno cicloeucalenol,
contribuíram com os primeiros relatos de atividade inseticida frente às ninfas
Bemesia tabaci (mosca branca) com resultado superior a droga comercial utilizada
para o controle do inseto.
Agradecimentos
UFAM, INPA, FAPEAN, CAPES
Referências
CHAMPAGNE, D.; KOUL, L; ISMAN, M.B. 1992. Biological activity of limonoids from the Rutales. Phytochemistry, 31: 377-394.
CHENG, Y.; CHIEN, Y.; LEE, J.; TSENG, C.; WANG, H.; LO, I.; CHANG, F; 2014. Limonoids from the Seeds of Swietenia macrophylla with Inhibitory Activity against Dengue Virus 2. Journal of Natural Products, 77:2367–2374.
CHIMELI, A. B.; BOYD, R. G. 2010. Prohibition and the Supply of Brazilian Mahogany. Economics, 86: 191-208.
ROY, A.; SARAF, S. 2006. Limonoids: Overview of significant bioactive triterpenes distributed in plants kingdom. Biology and Pharmaceutical Bulletin, 29: 191-201.
SAAD, M.; IWAGAWA, T.; DOE, M.; NAKATANI, M. 2003. Swietenialides, novel ring D opened phragmalin limonoid orthoesters from Swietenia mahogani JACQ. Tetrahedron, 59: 8027–8033.
TAYLOR, D.A.H. 1984. The Chemistry of the Limonoids from Meliaceae. Department of Pure and Applied Chemistry, University of Natal, Durban, South Africa, 102p.
















