Autores
Cedeño Fierro, V. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Mendoza Marín, C.M. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Grisales Mejía, J.F. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Torres Castañeda, H.G. (UNIVERSIDAD NACIONAL DE COLOMBIA)
Resumo
Siete solventes eutécticos naturales (NADES) con relación 1:1 y etanol (70%)
fueron utilizados en la extracción asistida por ultrasonido de flavonoles totales
del cáliz de uchuva, se seleccionó el mejor NADES y se realizó la optimización de
la extracción, con el fin de presentar una alternativa eco-amigable y natural para
la obtención de estos compuestos y la valorización de este residuo agroindustrial.
El mejor resultado en extracción del contenido total de flavonoles (CTFl) se
obtuvo con cloruro de colina-glicerol (8,72 mg ER/ g MS). Se realizó la
optimización de tres parámetros de extracción: tiempo, contenido de agua en el
NADES y razón M/S (mg Muestra/ mL Solvente). Las condiciones óptimas en el proceso
de extracción fueron 43,33 min, 41,51 % de agua y 56,36 mg muestra/ml solvente.
Palavras chaves
Physalis peruviana ; NADES; Flavonoles
Introdução
La uchuva (Physalis peruviana L) es un fruto tropical originario de los andes
suramericanos (Chile, Perú, Ecuador y Colombia) (ALVAREZ et al, 2020), de él
pueden obtenerse industrialmente jugos, salsas, conservas, entre otros
productos. De su aprovechamiento industrial se generan residuos, entre los que
se encuentran semillas, epicarpio y cáliz, este último es la primera defensa del
fruto frente a las condiciones exteriores, su efecto protector se ha asociado a
diferentes sustancias que actúan como repelentes y antioxidantes naturales
(FISCHER y HERRERA, 2011). Diferentes investigaciones han reportado la presencia
de compuestos bioactivos en el cáliz de uchuva incluyendo los flavonoides,
dentro de los cuales la rutina (un flavonol) es el compuesto mayoritario (TORO
et al, 2014; ECHEVERRY et al, 2018).
Los flavonoides son uno de los grupos más abundantes de metabolitos secundarios
encontrados dentro de la extensa familia de compuestos fenólicos y se han
reportado más de 7.000 moléculas diferentes (CROZIER et al, 2007), participan en
la generación de diversidad de colores en frutos y flores, en la protección
frente a los rayos UV, infecciones, microrganismos, entre otras (KHOO et al,
2017). Además, tienen un potencial uso en la industria farmacéutica,
cosmetológica y alimentaria. Diversos autores han reportado que exhiben gran
variedad de actividades biológicas como actividad antiinflamatoria (FREITAS et
al, 2014), antioxidante (MUDERRISOGLU et al, 2022), neuroprotectora (MENGYUE et
al, 2020), antiviral y antimicrobiana (PANDEY et al, 2021), entre otras, lo que
los convierte en compuestos de gran interés industrial.
Diversas investigaciones han surgido con la finalidad de extraer compuestos que
puedan ser aplicados en diferentes productos industriales, como respuesta a la
gran demanda de productos naturales, sin embargo, convencionalmente las
extracciones son realizadas con solventes orgánicos que dificultan la aplicación
de los extractos obtenidos. Por lo anterior se han desarrollado alternativas eco
amigables y sostenibles dentro de los principios de la química verde, que
permiten obtener grandes rendimientos de extracción (WU et al, 2021), entre
ellas los solventes eutécticos naturales, NADES (por sus siglas en inglés),
presentan gran potencial. Los NADES son el resultado de la mezcla entre un
donador y un aceptor de puentes de hidrogeno a determinada razón molar (CHOI et
al, 2011) y el aceptor más utilizado ha sido el cloruro de colina en
combinaciones con diferentes ácidos orgánicos (GONTRANI et al, 2019).
En esta investigación se analizaron diferentes NADES para la extracción de
flavonoles en el cáliz de uchuva. Se utilizó un diseño de optimización con el
solvente que obtuvo mayor rendimiento a fin de encontrar las mejores condiciones
de extracción, presentando una alternativa de extracción verde que permita dar
valor a este residuo agroindustrial
Material e métodos
2. Metodología
2.1 Material vegetal
Los frutos frescos de uchuva (cáliz y fruto) se obtuvieron de la granja Botana
de la Universidad de Nariño en Pasto, Colombia. Los frutos fueron llevados al
laboratorio de química, bioquímica y fitoquímica de la universidad Nacional de
Colombia, sede Palmira, en donde se retiraron de su cáliz. Las muestras fueron
ultracongeladas (-40°C) y liofilizadas, posteriormente el material fue procesado
en un molino y tamizado (< 250 um).
2.2 Preparación de solventes de extracción
Se prepararon siete solventes (NADES) bicomponentes según metodología propuesta
por (DAI et al, 2013) con algunas modificaciones, se utilizó cloruro de colina
(CC) como aceptor y glicerol (GLI), fructosa (F), glucosa (GLU), sacarosa (SC),
ácido málico (AM), láctico (AL) y cítrico (AC) como donadores de hidrógeno. Cada
componente fue mezclado a razón molar 1:1 en recipientes herméticos y calentado
en un baño de aceite mineral a 80 °C con agitación constante, el tiempo de
formación para cada uno se determinó hasta obtener un líquido transparente y
completamente homogéneo. Al finalizar se añadió 10% de agua tipo l a cada
solvente.
2.3 Selección del NADES
Con el objetivo de seleccionar el mejor NADES para la extracción de flavonoles
del cáliz de uchuva, se realizó una extracción inicial empleando la metodología
propuesta por TORRES et al. (2013), con algunas modificaciones. Se pesaron 100
mg de la muestra (Ohaus PA-124C) y se agregó 1 ml del solvente correspondiente
en cada tubo, se colocaron en baño de ultrasonido a 23°C por 10 minutos (Branson
2510, 47KHz -130W) y se centrifugaron a 7500 rpm-15min (Mini centrifuga, Fisher
Scientific), el sobrenadante fue retirado, filtrado y ultracongelado hasta los
análisis posteriores. Se incluyó etanol al 70% en agua como solvente de
referencia.
2.4 Determinación de flavonoles totales
Se prepararon diluciones de los extractos obtenidos en agua tipo I y se
determinó el contenido total de flavonoles utilizando una solución de tricloruro
de aluminio según la metodología propuesta por PEKAL Y PYRZYNSKA (2014) adaptado
a microplacas con algunas modificaciones; la lectura se realizó a 405 nm. Para
la curva de calibración (R²= 0,9997) se utilizó rutina como estándar (4-128
mg/L), Los resultados del contenido total de flavonoles (CTFl) fueron expresados
en miligramos equivalentes de rutina por gramo de muestra seca (mg ER/g MS).
2.5 Optimización de parámetros de extracción
El solvente NADES que presentó el mayor rendimiento en flavonoles totales fue
usado para optimizar los parámetros del proceso de extracción mediante un diseño
Box- Behnken. Los parámetros optimizados fueron el porcentaje de agua en el
NADES (10 a 70% v/v), el tiempo (10 a 70 min) y la razón muestra/solvente (35 a
120 mg/mL). El software estadístico utilizado para la generación del diseño y el
anova fue MATLAB “2021a”
Resultado e discussão
3. Resultados y discusión
3.1 Selección del solvente
Se realizaron extracciones con 7 NADES diferentes con el fin de seleccionar el
más adecuado para la extracción de flavonoles de cáliz de uchuva (Physalis
peruviana). La selección del NADES depende en gran medida de factores como
solubilidad, polaridad, viscosidad, tiempo de extracción, entre otros (DAI et
al, 2013). Como se conoce, la viscosidad es uno de los principales factores
negativos con los que cuentan este tipo de solventes, puesto que no solo
dificultan su manejo sino que limitan la transferencia de masa en la extracción
(IVANOVIC et al, 2018).Este efecto puede verse reducido con la adición de agua,
para este estudio se fijó como una condición estándar la adición de 10% de agua
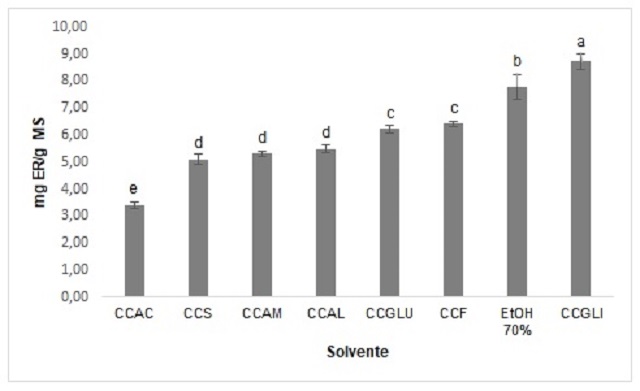
en cada solvente, en la Figura 1 es posible observar que el NADES elaborado con
glicerol obtuvo el mejor resultado en extracción de flavonoles, incluso por
encima del obtenido con el solvente orgánico convencional, JURI et al. (2021)
también reportaron el mejor rendimiento en extracción de flavonoles para NADES
basado en cloruro de colina y glicerol en comparación con etanol (70%); DA
SILVA et al. (2020) también reporto un incremento en la extracción de un tipo de
flavonoides con NADES por encima de mezclas hidroalcohólicas, esto puede deberse
a la formación de puentes de hidrógeno que a su vez interaccionan con los
metabolitos y a la polaridad del solvente; Por el rendimiento en la extracción
(8,72 mg ER/ g MS) fue seleccionado el NADES basado en cloruro de colina-
glicerol (1:1) como solvente de extracción.
Figura 1 Contenido total de flavonoles (CTFl) en cáliz de uchuva empleando
NADES: cloruro de colina (CC), glicerol (GLI), fructosa (F), glucosa (GLU),
sacarosa (SC), ácido málico (AM), láctico (AL) y cítrico (AC). Las medias que no
comparten la misma letra presentan diferencias significativas.
3.2 Optimización de parámetros de extracción
El modelo de regresión en la determinación del CTFl fue significativo (p<0,05)
según el ANNOVA presentado en la tabla 1. El efecto lineal del tiempo y M/S y el
efecto cuadrático del tiempo, M/S, %Agua y fueron significativos para la
extracción de CTFl (figura 2b); El ajuste del modelo pudo determinarse gracias
al valor p obtenido en la falta de ajuste. Se presentó un coeficiente de
regresión de R²= 0,985.
Tabla 1. Análisis de varianza del diseño de optimización para extracción de
flavonoles totales del cáliz de uchuva. Grados de libertad (GL), Suma de
cuadrados (CM), Cuadrado medio (CM). Significancia valor p <0,05
CTFl
(mg ER/g MS)
GL SC CM Valor F Valor P
Modelo 8 68,1491 8,519 50,740 0,000
Lineal 3 22,615 7,538 44,900 0,000
Tiempo 1 14,802 14,802 88,160 0,000
% Agua 1 0,705 0,705 4,200 0,086
M/S 1 7,108 7,108 42,330 0,001
Cuadrático 3 24,346 8,116 48,330 0,000
Tiempo*Tiempo 1 12,689 12,689 75,570 0,000
% Agua*% Agua 1 12,111 12,111 72,130 0,000
M/S*M/S 1 2,704 2,704 16,100 0,007
Interacciones dobles 2 21,188 10,594 63,090 0,000
Tiempo*%Agua 1 2,994 2,994 17,830 0,006
Tiempo*M/S 1 18,194 18,194 108,360 0,000
Error 6 1,0074 0,168
Falta de ajuste 4 0,645 0,161 0,89 0,591
Error puro 2 0,363 0,181
Total 14 69,157
R² 0,985
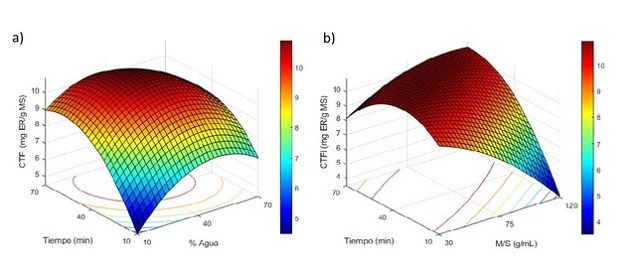
La figura 2. presenta los gráficos de superficie para el contenido total de
flavonoles. En la figura 2a es posible observar que a menor contenido de agua y
tiempo se obtienen los menores resultados, debido principalmente al aumento de
la viscosidad del solvente y al tiempo que toma la trasferencia mediada por
fenómenos de difusión, en la medida que estos dos parámetros aumentaron se
evidenció un incremento en la extracción. Sin embargo, el aumento del contenido
de agua en el solvente (>50%), causa una disminución en el rendimiento.
MIGLIORATI et al. (2019) presentaron un comportamiento similar explicando cómo
se desfavorece la extracción a medida que se incrementa el contenido de agua en
el NADES, por el debilitamiento de los puentes de hidrógeno entre los
componentes del solvente. En la figura 2b es posible observar que el rendimiento
en la extracción de flavonoles se ve favorecido a valores intermedios tanto de
M/S como tiempo. El decrecimiento para largos tiempos de extracción puede
deberse posiblemente al daño de los metabolitos y al debilitamiento de los
enlaces entre el solvente, también es posible observar que bajos tiempos de
extracción a una alta relación M/S desfavorecen la extracción, debido
principalmente a la baja difusión del solvente.
Figura 2. Superficie de respuesta para el efecto de los parámetros de extracción
obre el contenido total de flavonoles (CTFl). a) efecto del tiempo y contenido
de agua en el NADES. b) efecto del tiempo y razón M/S.
Las condiciones óptimas encontradas para la extracción de flavonoles del cáliz
de uchuva fueron 43,33 min, 41,51 % de agua y 56,36 g muestra/ml solvente y el
rendimiento teórico para flavonoles totales bajo los parámetros óptimos fue
10,939 mg ER/g MS.
Contenido total de flavonoles (CTFl) en cáliz de uchuva empleando NADES basados en cloruro de colina (CC)
Superficie de respuesta para el efecto de los parámetros de extracción sobre el contenido total de flavonoles (CTFl).
Conclusões
Los NADES utilizados en este trabajo mostraron ser mucho más efectivos en la
extracción de flavonoles de cáliz de uchuva que el solvente convencional (etanol
al 70% en agua). Esto demuestra una vez más la gran capacidad de los NADES como
solventes para la extracción verde de metabolitos secundarios. La optimización de
los factores permite mejorar el proceso de extracción con el objetivo de obtener
el mayor rendimiento posible y generar un potencial método para la extracción de
bioactivos del cáliz de uchuva, dándole un uso a este residuo agroindustrial.
Agradecimentos
Los autores agradecen a la Universidad Nacional de Colombia Sede Palmira por su
partipación mediante el proyecto Hermes No. 49205
Referências
ALVAREZ, G., BALLESTEROS, D., IBÁNEZ, E., PARADA, F., & CIFUENTES, A. (2020). Foodomics of Bioactive Compounds From Tropical Fruits By-Products. Reference Module in Food Science. doi:10.1016/b978-0-08-100596-5.22882-5
CHOI, Y.H., VAN SPRONSEN, J., DAI, Y., VERBEME, M., HOLLMANN, F., ARENDS, I.W…. VERPOORTE, R. (2011). Are Natural Deep Eutectic Solvents the Missing link in Understanding Cellular Metabolism and Physiology?. Plant Physiology, 156,1701.
CROZIER, A., JAGANATH, I., CLIFFORD, M. (2006). Phenols, polyphenols and tannins: an overview. Plant Secondary Metabolites: Occurrence, Structure and Role in the Human Diet, Blackwell Publishing Ltd.
DAI, Y., VAN SPRONSEN, J., WITKAMP, G.J., VERPOORTE, R., CHOI, Y.H. (2013)
Natural deep eutectic solvents as new potential media for green technology
Anal. Chim. Acta, 766 , pp. 61-68, doi10.1016/j.aca.2012.12.019
DA SILVA, D. T., PAULETTO, R., DA SILVA CAVALHEIRO, S., BOCHI, V. C., RODRIGUES, E., WEBER, J., … EMANUELLI, T. (2020). Natural deep eutectic solvents as a biocompatible tool for the extraction of blueberry anthocyanins. Journal of Food Composition and Analysis, 103470. doi:10.1016/j.jfca.2020.103470
ECHEVERRY, S.M., VALDERRAMA, I.H., COSTA, G.M., OSPINA, L.F., ARAG´ON, D.M. (2018) Development and optimization of microparticles containing a hypoglycemic fraction of calyces from Physalis peruviana, J. Appl. Pharmaceut. Sci. 8.10–18. doi.org/10.7324/JAPS.2018.8502.
FISCHER, G., & HERRERA, M. (2011). Cape gooseberry (Physalis peruviana L.). In E. Yahia (Vol. Ed.), Postharvest biology and technology of tropical and subtropical fruits: Vol. 2: Açai to citrus, (pp. 374–396). Cambridge, UK: Woodhead Publishing
FREITAS, M., RIBEIRO, D., TOMÉ M.S., SILVA, M.S., FERNANDES, E.2014). Anti-inflammatory and pro-apoptotic activities of chlorinated flavonoids in human neutrophils. Free Radical Biology and Medicine, 75, S30. doi:10.1016/j.freeradbiomed.2014.10.760
GONTRANI, L., PLECHKOVA, N.V., BONOMO, M. (2019). In-depth physico-chemical and structural investigation of a dicarboxylic acid/choline chloride natural deep eutectic solvent (NADES): a spotlight on the importance of a rigorous preparation procedure. ACS Sustain. Chem. Eng., 7, pp. 12536-12543
IVANOVIĆ, M., ALAÑÓN, M. E., ARRÁEZ, R. D., & SEGURA, C. A. (2018). Enhanced and green extraction of bioactive compounds from Lippia citriodora by tailor-made natural deep eutectic solvents. Food Research International, 111, 67–76. doi:10.1016/j.foodres.2018.05.014
JURI, T., MI, N., TRIVUNOVI, Z., & POPOVI, B. M. (2021). The evaluation of phenolic content, in vitro antioxidant, and antibacterial activity of Mentha piperita extracts obtained by natural deep eutectic solvents. 362(May). 10.1016/j.foodchem.2021.130226.
KHOO, H.E., AZLAN, A., TANG, S.T., LIM, S.M. (2017) Anthocyanidins and anthocyanins: Colored pigments as food, pharmaceutical ingredients, and the potential health benefits. Food & Nutrition Research, 61(1), 1361779. doi:10.1080/16546628.2017.1361779
MENGYUE Li, XI, G., MINGXIAN, L., XIANBIN, L., FAWU S., LIMING, F., YUHAN, Z., XIAOJIANG, H., GUOXING, W, XIAO, D. (2020). Inhibitory activities of flavonoids from Eupatorium adenophorum against acetylcholinesterase.Pesticide Biochemistry and Physiology, Volume 170,104701,ISSN 0048-3575,doi.org/10.1016/j.pestbp.2020.104701
MIGLIORATI, V., SESSA, F., & D´ANGELO, P. (2019). Deep eutectic solvents: A structural point of view on the role of the cation. Chemical Physics Letters, 737, 100001.
MUDERRISOGLU, S., CENESIZ, S., YARIM, M. (2022). Determination of the effect of Quercetinon oxidant- antioxidant parameters in the blood and liver tissues of rats given sodium fluoride experimentally.Journal of the Indian Chemical Society.Volume 99, Issue 7,2022,100486,ISSN 0019-4522.doi.org/10.1016/j.jics.2022.100486
PANDEY, P., KHAN, F., QARI, H.A., OVES, M. (2021) Rutin (Bioflavonoid) as Cell Signaling Pathway Modulator: Prospects in Treatment and Chemoprevention. Pharmaceuticals; 14(11):1069. https://doi.org/10.3390/ph14111069
PĘKAL, A., & PYRZYNSKA, K. (2014). Evaluation of Aluminium Complexation Reaction for Flavonoid Content Assay. Food Analytical Methods, 7(9), 1776–1782. https://doi.org/10.1007/s12161-014-9814-x
TORO, R.M., ARAGÓN, D.M., OSPINA, L.F, RAMOS, F.A., CASTELLANOS L. (2014) Phytochemical analysis, antioxidant and anti-inflammatory activity of calyces from physalis peruviana, Nat. Prod. Commun. 9 .1573–1575, https://doi.org/10.1177/ 1934578x1400901111
TORRES, H., COLMENARES A. J. E ISAZA J. H. (2013). Total phenolics, antioxidant actvity and phytochemical profile of somo plants from the Yotoco national protected forest.
Valle del Cauca, Colombia.Revista de Ciencias.17, 33-44
WU, L., CHEN, Z., LI, S., WANG, L., & ZHANG, J. (2021). Eco-friendly and high-efficient extraction of natural antioxidants from Polygonum aviculare leaves using tailor-made deep eutectic solvents as extractants. Separation and Purification Technology, 262, 118339. doi:10.1016/j.seppur.2021.118339
















