Autores
Fernandes, A.I. (UFLA) ; Cardoso, M.G. (UFLA) ; Oliveira, C.D. (UFLA) ; Alves, M.V.P. (UFLA) ; Carvalho, G.C.P. (UFLA) ; Jesus, L.R.M. (UFLA) ; Freire, C.S. (UFLA) ; Campolina, G.A. (UFLA) ; Ferreira, V.R.F. (UFLA) ; Batista, L.R. (UFLA)
Resumo
O trabalho visou avaliar a atividade biológica do óleo essencial de salsa sobre
Aspergillus ochraceus, produtor de micotoxinas prejudiciais à saúde humana.
O óleo essencial foi obtido por hidrodestilação em aparelho de Clevenger modificado
e a atividade antifúngica analisada pelo cultivo do fungo em meio com três
concentrações do óleo. Nas concentrações propostas, os componentes do óleo
essencial inibiram o crescimento fúngico em 67,81%, 72,77% e 77,21% para as
concentrações 1,235, 2,47 e 4,95 µL mL-1, respectivamente. Assim, o óleo
de salsa mostra-se como alternativa promissora para a substituição de conservantes
industriais, promovendo maior tempo de prateleira sem que haja danos à saúde do
consumidor e agregando características sensoriais ao mesmo.
Palavras chaves
Petroselinum crispum; Micotoxinas; Aspergillus
Introdução
A busca da segurança alimentar e a promoção da agricultura sustentável consiste
em um dos 17 Objetivos de Desenvolvimento Sustentável (ODS) desejáveis de serem
alcançados até 2030. Entretanto, a disseminação de pragas e a contaminação
microbiana pós-colheita em alimentos são fatores desfavoráveis para que seja
alcançado este objetivo (TIWARI; DUBEY, 2022). Segundo dados apresentados por
Groot, Abee e Veen (2019), é estimada uma perca de 25% da produção mundial de
alimentos por contaminação microbiana; destes, estima-se que entre 5-10%, são
resultados do crescimento e metabolismo fúngico de espécies como
Fusarium, Penicillium e Aspergillus. Para Chang et al.
(2022), os fungos do gênero Aspergillus são microrganismos saprofíticos
presentes em todos os ambientes. Tortora, Funke e Case (2017) explicam que esses
indivíduos podem apresentar aplicações tanto benéficas quanto nocivas. Algumas
espécies de Aspergillus podem ser utilizadas para a fermentação de arroz,
gerando produtos como o saquê pelo Aspergillus oryzae e na produção de
ácido cítrico pelo Aspergillus niger. Em contrapartida, algumas espécies
desse mesmo gênero são capazes de induzir problemas de saúde, como a
aspergilose, doença invasiva resultante da colonização do Aspergillus
fumigatus em pessoas imunocomprometidos, principalmente. Além deste, durante
seu crescimento, fungos do gênero Aspergillus são capazes de produzir
micotoxinas carcinogênicas, como as aflatoxinas e ocratoxinas, produzidas pelo
Aspergillus ochraceus ao colonizarem grãos de milho, arroz, cevada e
amendoim, por exemplo.
No que diz respeito ao controle do crescimento de patógenos e da produção de
micotoxinas, a utilização de conservantes químicos e técnicas como a
pasteurização e esterilização de alimentos são utilizadas de forma eficaz. No
entanto, podem modificar o valor nutricional e sensorial dos alimentos ou
ocasionar efeitos adversos à saúde. Para fins fungicidas, é desejável um
produto que apresente eficiência microbicida e preservando o teor nutricional,
características e atributos sensoriais. Com isso, a utilização de produtos
naturais, como óleos essenciais, é vista como promissora na conservação de
alimentos (ALIZADEH et al., 2021; TIWARA; DUBEY, 2022).
Os óleos essenciais (OE) podem ser definidos como uma mistura de compostos
voláteis formados a partir do metabolismo secundário das plantas que, por sua
constituição química vasta e complexa, possuem diversas atividades biológicas
comprovadas (LUNGUINHO et al., 2021). Baseando na ideia do consumismo verde,
quando atrelada aos benefícios proporcionados pelo consumo, os óleos essenciais
vêm ganhando maiores espaços e aplicações, podendo ser utilizado para fins
medicinais, alimentícios, industriais e agroquímicos. Por apresentarem
atividades microbicidas e atributos sensoriais característicos, os óleos
essenciais de condimentos e especiarias podem ser vias alternativas para a
conservação de alimentos, agregando valor e prolongando a vida útil destes
(MILLEZI et al., 2012; SOUSA et al., 2021).
A salsa (Petroselinum crispum Mill.), é um condimento pertencente à
família Apiaceae, de grande consumo mundial e de diversos benefícios à saúde
humana, sendo fonte de vitaminas, minerais, imunidade e diversos compostos
bioativos. Por ser uma planta facilmente encontrada, é possível que o consumo
desta seja frequente e acessível por diversas classes. Graças a sua composição
química, além do uso culinário, a utilização de diversos tipos de salsa para
fins medicinais já foi comprovada, sendo eficazes microbicidas, antissépticos,
antiinflamatórios, digestivos, antifúngicos, diuréticos e anticoagulantes, por
exemplo (FARZAEI et al., 2013; SANY; SAID-ALAHL; ASTATKIE, 2022).
O presente trabalho objetivou a obtenção do óleo essencial de salsa e avaliar
seu potencial fungicida sobre Aspergillus ochraceus
Material e métodos
A salsa desidratada em flocos foi obtida no Mercado Municipal de Belo Horizonte,
Belo Horizonte, Minas Gerais.
A extração do óleo essencial (OE), foi realizada no Laboratório de
Química Orgânica do Departamento de Química da Universidade Federal de Lavras
(DQI-UFLA) por hidrodestilação, utilizando um aparelho Clevenger modificado. Em
um balão com capacidade para 5 litros, foram colocados 250g de material vegetal
seco e 2,5L de água. Após acoplado ao condensador, o sistema foi aquecido por 2
horas. O hidrolato obtido foi centrifugado (Fanem Baby I – Modelo 2006BL) a
965XG por 15 minutos e o óleo obtido foi separado, armazenado sob refrigeração e
abrigo de luz. Paralelamente, foi realizada a mensuração de água no material
vegetal, seguindo a metodologia de Pimentel et al. (2006). O rendimento do
produto obtido foi expresso como em base de peso seco em relação ao peso do
material vegetal.
O potencial antifúngico foi analisado pelo método de contato, descrito por
Brandão et al, (2020) sobre Aspergillus ochraceus. A espécie fúngica foi
adquirida da Coleção de Culturas de Microrganismos do Laboratório de Micotoxinas
e Micologia de Alimentos da UFLA. O óleo essencial foi diluído em
dimetilsulfóxido (DMSO) nas seguintes concentrações: 4,95, 2,47 e 1,235 µL
mL-1 e adicionadas ao meio Malt Agar (MA). Em placas estéreis, foram
adicionados 20mL de meio MA e, sucessivamente, inoculadas com um volume de 10µL
de solução de esporos (106 esporos mL-1), preparada com
10mL de Solução de Tween 80 a 1%. Como Grupos-Controle, foram cultivados fungos
na ausência de óleo essencial e na presença de DMSO. As placas foram incubadas
em BOD a 25ºC por sete dias. Decorrido este período, o crescimento dos fungos
foi avaliado pelo diâmetro micelial obtido em cada tratamento.
O porcentual de inibição fúngica foi calculado pela equação: I=[(dc-
dt)/dc] x 100, onde dc e dt
representam, respectivamente, o crescimento micelial do controle fúngico e o
crescimento micelial do fungo nos tratamentos contendo óleo essencial. A
Concentração Fungicida Mínima (CFM) foi determinada como a menor concentração de
OE capaz de inibir o crescimento micelial das espécies utilizadas.
Os dados de inibição fúngica foram submetidos à análise de variância e
comparados pelo Teste de Tukey a 5% de significância utilizando o programa
estatístico Sisvar (FERREIRA, 2011).
Resultado e discussão
O rendimento do óleo essencial de salsa foi de 0,42% em base de peso seco,
convergindo com dados de rendimentos já relatados na literatura. Estudando óleos
essenciais de salsa fresca obtidos pela mesma metodologia aplicada neste
trabalho, Linde et al, (2016) obtiveram 0,2% para rendimento do mesmo, enquanto
Kurowska e Gałązka (2006) conseguiram rendimento entre 1,5 e 2,2% para distintos
tipos de salsa fresca. Semelhante ao presente estudo, Corrêa Filho et al. (2018)
obtiveram valor de rendimento médio de 0,33% a partir da hidrodestilação de
salsa seca.
O resultado obtido para o rendimento neste trabalho foi ligeiramente inferior, o
que pode ser explicado por fatores internos e externos. Além das práticas
agronômicas, fatores como parâmetros fisiológicos e fotossintéticos e o ambiente
externo, como temperatura, umidade e intensidade da luz, são capazes de
influenciar na constituição química e nos produtos do metabolismo vegetal
(GOBBO-NETO; LOPES, 2007; SANY; SAID-ALAHL; ASTATKIE, 2022). A utilização de
espécies diferentes ou da mesma espécie coletada em locais diferentes podem
apresentar efeitos significativos em relação a compostos químicos, mas o
rendimento a partir de plantas secas ou frescas não diferem significativamente
(CORRÊA FILHO et al.,2018).
A Figura 1 e a Tabela 1 apresentam os resultados de inibição fúngica obtida nas
concentrações utilizada sobre A. ochraceus , respectivamente. Os volumes
de
óleo foram capazes de alterar significativamente o crescimento fúngico. Estudos
posteriores com concentrações maiores devem ser realizados.
O estudo do uso do óleo essencial de salsa para fins microbicidas ou
microbioestáticos ainda são escassos na literatura, principalmente para o fungo
estudado nesse trabalho. Ao analisar o poder microbicida do óleo essencial de
salsa sobre Aspergillus niger e Aspergillus flavus , Mahmoud,
Rahma
e Osheba (2020) obtiveram diâmetros de inibição equivalentes a 43mm e 40mm,
respectivamente, enquanto Linde e colaboradores (2016) obtiveram resultados
fungicida utilizando concentrações mínimas 10, 12.3 e 12.4 mg mL-1 para A.
fumigatus, A. niger e A. ochraceus , respectivamente.
O potencial microbicida da salsa também pode ser visto na utilização de outros
produtos, como extratos. O uso de extratos microbicidas de salsa foi estudado
por Pineda e colaboradores (2018), que analisaram o poder inibitório de óleo e
extratos de salsa para Collectotrichum acutatum e obtiveram resultados
satisfatórios utilizando concentrações superiores a 100 μg mL-1, sendo o óleo
mais efetivo que os extratos.
Além da atividade biológica sobre variadas espécies de fungos, o óleo essencial
de salsa também possui atividade bactericida já relatada na literatura para
diversas bactérias contaminantes de alimentos, como as do gênero Vibrio
ssp.,
Escherichia coli, Staphylococcus aureus, Listeria monocytogenes, Bacillus
cereus e Salmonella enteritidis (BADEE et al., 2020; LINDE et
al.¸2016; SNOUSSI et al., 2016).
O potencial microbicida dos óleos essenciais pode ser explicado pela ação em
diversos mecanismos de ação. Brandão et al. (2022) explica que a atividade
biológica dos óleos essenciais pode este relacionada ao caráter lipofílico de
seus constituintes, que são capazes de penetrar a membrana celular, ocasionando
perturbação aos componentes celulares e interferindo na fluidez e
permeabilidade. Além da ação sobre a membrana plasmática, a ação antifúngica de
óleos essenciais também pode ser vista no comprometimento metabólico das
células, ocasionando a acidificação da matriz extracelular, inibição de enzimas
desidrogenases e ATPases ou até mesmo na influência direta do ciclo de Krebs
(CHAUDHARI et al., 2019). Todos esses fatores, quando de forma individual ou
conjunta, são capazes de promover a morte celular fúngica.
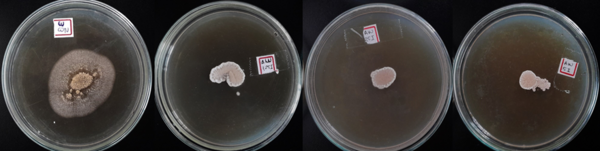
Inibição fúngica sobre A. ochraceus utilizando OE de salsa nas concentrações 0; 1,235; 2,47 e 4,95 µL mL- 1, respectivamente. Fonte: Os Autores.

Médias seguidas da mesma letra minúscula nas colunas, não diferem entre si pelo Teste Tukey a 5% de probabilidade. Fonte: os autores.
Conclusões
O rendimento final do óleo essencial esteve em consonância com outros estudos
realizados utilizando a mesma planta. Com base nas concentrações testadas e nos
resultados obtidos neste trabalho, o óleo essencial de salsa apresentou controle
eficaz do crescimento fúngico sobre A. ochraceus . Estudos futuros
relacionados a caracterização química, às atividades antioxidantes e microbicidas
com concentrações superiores às concentrações utilizadas neste trabalho, bem como
a
melhor forma de utilização deste são desejáveis, a fim de confirmar seu uso
alternativo para a conservação de alimentos e a minimização de contaminação
alimentícia por microrganismos.
Agradecimentos
À Universidade Federal de Lavras (UFLA), à FAPEMIG – projeto CAG/APQ 02390/2018),
CAPES (001), CNPq (projeto nº 309733/2017-0) e a EMBRAPA pela concessão de bolsas
e apoio financeiro.
Referências
ALIZADEH, A. M.; HASHEMPOUR-BALTORK, F.; KHANENGHAH, A. M. HOSSEINI, H. New perspective approaches in controlling fungi and mycotoxins in food using emerging and green Technologies. Current Opinion in Food Science, v. 39, p. 7-15, 2021.
BADEE, A. Z. M.; SALAMA, N. A. E. R.; ISMAIL, M. A. K. Effect of Drying Methods on the Chemical Composition and Biological Activity of Parsley Herb Essential Oil. Pakistan Journal of Biological Sciences, v. 23, p. 839-847, 2020.
BRANDÃO, R. M.; CARDOSO, M. G.; BATISTA, L. R.; CAETANO, A. R. S.; LEMOS, A. C. C.; MARTINS, M. A.; NELSON, D. L.; OLIVEIRA, J. E. Antifungal and physicochemical properties of Ocimum essential oil loaded in poly(lactic acid) nanofibers. Letters in Applied Microbiology, v. 74, n. 5, p. 765-776, 2022.
BRANDÃO, R. M.; FERREIRA, V. R. F.; BATISTA, L. R.; ALVES, E.; LIRA, N. A.; BELLETE, B. S.; SCOLFORO, J. R. S.; CARDOSO, M. G. Antifungal and antimycotoxigenic effect of the essential oil of Eremanthus erythropappus on three different Aspergillus species. Flavour and Fragrance Journal, v. 35, n. 5, p. 524-533, 2020.
CHANG, K. M.; KIM, A. C.; JURADO, J. E.; DONAGHY, H. Aspergillus pleural empyema in a chronic smoker – A case report and review of literature. Journal of Medical Mycology, v. 32, n. 4, 2022.
CHAUDHARI, A. K.; DWIVEDY, A. K.; SINGH, V. K.; DAS, S.; SINGH, A.; DUBEY, N. K. Essential oils and their bioactive compounds as green preservatives against fungal and mycotoxin contamination of food commodities with special reference to their nanoencapsulation. Environmental Science and Pollution Research, v. 26, p. 25414-25431, 2019.
CORRÊA FILHO, L. C.; MARTINAZZO, A. P.; TEODORO, C. E. S.; VIVÈS, L. Microbiological quality and essential oil of parsley (Petroselinum crispum) submitted to the hygienizing and drying process. Industrial Crops and Products, v. 114, p. 180-184, 2018.
FARZAEI, M. H.; ABBASABADI, Z.; ARDEKANI, M. R. S.; RAHIMI, R.; FARZAEI, F. Parsley: a review of ethnopharmacology, phytochemistry and biological activities. Journal of Traditional Chinese Medicine, v. 33, n. 6, p. 815-826, 2013.
FERREIRA, D. F. Sisvar: a computer statistical analysis system. Ciencia e Agrotecnologia, v. 35, p. 1039-1042, 2011.
GOBBO-NETO, L.; LOPES, N. P. Plantas medicinais: fatores de influência no conteúdo de metabólitos secundários. Química Nova, n. 30, p. 374–381, 2007.
GROOT, M. S.; ABEE, T.; VEEN, H. V. B. Inactivation of conidia from three Penicillium spp. isolated from fruit juices by conventional and alternative mild preservation technologies and disinfection treatments. Food Microbiology, v. 81, p. 108-114, 2019.
KUROWSKA, A.; GAŁĄZKA, I. Essential oil composition of the parsley seed of cultivars marketed in Poland. Flavour and Fragance Journal, v. 214, p. 143-147, 2006.
LINDE, G. A.; GAZIM, Z. C.; CARDOSO, B. K. JORGE, L. F.; TEŠEVIĆ, V.; GLAMOĆLIJA, J.; SOKOVIĆ, M. COLAUTO, N. B. Antifungal and antibacterial activities of Petroselinum crispum essential oil. Genetics and Molecular Research, v. 15, n. 3, 2016.
LUNGUINHO, A. S.; CARDOSO, M. G.; FERREIRA, V. R. F.; KKOONIG, I. F. M.; GONÇALVES, R. R. P.; BRANDÃO, R. M.; CAETANO, A. R. S.; NELSON, D. L.; REMEDIO, R. N. Acaricidal and repellent activity of the essential oils of Backhousia citriodora, Callistemon viminalis and Cinnamodendron dinisii against Rhipicephalus spp. Veterinary Parasitology, v. 300, 2021.
MAHMOUD, N. M.; RAHMA, E. H.; OSHEBA, A. S. Chemical componentes, antioxidant and antimicrobial activities of garlic, cumin and parsley volatile oils. Menoufia Journal Food & Dairy Science, v. 5, p. 53-63, 2020.
MILLEZI, A. F.; CAIXETAM D. S.; ROSSONI, D. F.; CARDOSO, M. G.; PICCOLI, R. H. In vitro antimicrobial properties of plant essential oils Thymus vulgaris, Cymbopogon citratus and Laurus nobilis against five important foodborne pathogens. Food Science and Technology, v. 32, n. 1, 2012.
PIMENTEL, F. A.; CARDOSO, M. G.; SALGADO, A. P. S. P.; AGUIAR, P. M.; SILVA, V. F.; MORAIS, A. R.; NELSON, D. L. A convenient method for the determination of moisture in aromatic plants. Quimica Nova, v. 29, 373– 375, 2006.
PINEDA, R.; VIZCAÍNO, S.; GARCÍA, C. M.; GIL, J. H.; DURANGO, D. Actividad antifúngica de extratos, aceite esencial y constituyentes de Petroselinum crispum contra Colletotrichum acutatum. Revista Facultad Nacional de Agronomía Medellín, v. 71, n. 3, 2018.
SANY, H.; SAID-ALAHL, H. A. H.; ASTATKIE, T. Essential oil content, yield, and components from the herb, leaf, and stem of curly-leafed parsley at three harvest days. Journal of Central European Agriculture, v. 23, n. 1, p. 54-61, 2022.
SNOUSSI, M.; DEHMANI, A.; NOUMI, E.; FLAMINI, G.; PAPETTI, A. Chemical composition and antibiofilm activity of Petroselinum crispum and Ocimum basilicum essential oils against Vibrio spp. Microbial Pathogenesis, v. 90, p. 13-21, 2016.
SOUSA, R. M. O. F.; CUNHA, A. C.; FERREIRA, M. F. The potential of Apiaceae species as sources of singular phytochemicals and plant-based pesticides. Phytochemistry, v. 187, 2021.
TIWARI, S.; DUBEY, N. K. Nanoencapsulated essential oils as novel green preservatives against fungal and mycotoxin contamination of food commodities. Current Opinion in Food Science, v. 45, 2022.
TORTORA, G. J.; FUNKE, B. R.; CASE, C. L. Microbiologia. 12ed. Porto Alegre: Artmed, 2017.
















