Autores
Castro, G.J.S. (UNIVERSIDADE FEDERAL DO MARANHÃO) ; Lima, A.S. (UNIVERSIDADE FEDERAL DO MARANHÃO) ; Sousa, D.M. (UNIVERSIDADE FEDERAL DO MARANHÃO) ; Silva, E.C.V. (UNIVERSIDADE FEDERAL DO MARANHÃO) ; da Rocha, C.Q. (UNIVERSIDADE FEDERAL DO MARANHÃO) ; Costa Junior, L.M. (UNIVERSIDADE FEDERAL DO MARANHÃO) ; Soares, A.M.S. (UNIVERSIDADE FEDERAL DO MARANHÃO)
Resumo
A Mimosa caesalpiniifolia Benth é fonte de compostos fenólicos contra
nematoides. O estudo busca avaliar a ação anti-helmíntica de frações ricas em
polifenóis do extrato de suas folhas. A extração foi feita com acetona 70% (v/v)
e o extrato foi fracionado em coluna de Sephadex LH-20. As 63 frações obtidas
foram analisadas por HPLC/UV-Vis, agrupadas segundo o perfil cromatográfico e
testadas contra Haemonchus contortus. As frações FRA-1 e FRA-2 foram
efetivas, com CI50 de 0,81 e 0,21 mg.mL-1,
respectivamente, sendo FRA-1 o agrupamento das frações com um pico
característico de tanino hidrolisável e FRA-2 das com picos indicativos de
taninos condensados. O estudo mostra o potencial anti-helmíntico das frações
obtidas das folhas de M. caesalpiniifolia.
Palavras chaves
Mimosa caesalpiniifolia; anti-helmínticos; compostos fenólicos
Introdução
Apesar dos avanços na pecuária intensiva, a grande incidência de nematoides
gastrointestinais continuam a ser uma das principais causas de doenças, redução
de produção e perdas econômicas na ovinocaprinocultura (SOARES; WANDERLEY; COSTA
JUNIOR, 2019). Os ovinos e caprinos têm papéis econômicos importantes em regiões
de climas tropicais e subtropicais, sendo que a combinação de altas temperaturas
e chuvas nessas áreas fornece um ambiente propício para o desenvolvimento de
nematoses (JACKSON; VÁRADY; BARTLEY, 2012; WALLER, 1997). Essas nematoses
prejudicam a deposição de tecido e a produção animal, com perdas variando entre
regiões, anos, estações e eficácia das medidas de controle (BESIER et
al., 2016; PARKINS; HOLMES, 1989).
O tratamento depende quase exclusivamente da quimioprofilaxia usando um número
limitado de drogas anti-helmínticas sintéticas comercialmente disponíveis
(GARCÍA et al., 2018; OLIVEIRA et al., 2011). Todavia, esses
produtos tem impactado negativamente no meio ambiente e na saúde dos hospedeiros
(SALGADO; SANTOS, 2016). Além disso, seu uso contínuo e, por vezes,
indiscriminado tem acarretado na seleção de parasitos resistentes o que acaba
por reduzir drasticamente a eficiência dessas drogas (ŠIMPRAGA et al.,
2015). Por conseguinte, abordagens alternativas tem sido investigadas com o
objetivo de alcançar compostos de alta eficiência, com menor impacto ambiental e
seguro para os animais (SOARES; WANDERLEY; COSTA JUNIOR, 2019).
Nessa perspectiva, compostos do metabolismo secundário de plantas têm sido
apontados como promissores ativos para o tratamento de infecções parasitárias
(WINK, 2012). Dentre esses, destacam-se os taninos que são tipicamente
classificados como taninos hidrolisáveis, condensados e florotaninos. Taninos
causam redução na carga parasitária, na excreção de ovos nas fezes e na
fecundidade dos parasitos (ENGSTRÖM et al., 2016; OLIVEIRA et al.,
2011; PAOLINI et al., 2003). Flavonoides, ácidos fenólicos e outros
compostos fenólicos também já demonstraram ter atividade anti-helmíntica em
diferentes estágios do ciclo de vida de nematoides (GAO et al., 2018;
KLONGSIRIWET et al., 2015; NDJONKA et al., 2014).
Os taninos condensados são os compostos fenólicos mais estudados para fins
teraupeuticos, por conta disso a Mimosa caesalpiniifolia Benth, que
possui uma alta concentração de taninos condensados nas folhas e caule, está
entre as plantas apontadas com capacidade repositória de notórios anti-
helmínticos (BRITO et al., 2017). Essa planta, conhecida popularmente
como “sabiá”, pertence a família Leguminosae e é caracterizada por rápido
crescimento, alta capacidade de regeneração e resistência à seca (PODADERA et
al., 2015). Já foi demonstrado in vitro a atividade anti-helmíntica
do extrato cetônico de suas folhas contra importantes nematoides
gastrointestinais (BRITO et al., 2017). Além disso, Brito et al.
(2018), observou diminuição da carga parasitária de vermes adultos de
Haemonchus contortus, a espécie de nematoide gastrointestinal de pequenos
ruminantes mais patogênica e economicamente importante, em caprinos que
receberam taninos condensados de M. caesalpiniifolia.
Diante deste cenário, este trabalho visa obter frações ricas em compostos
fenólicos de folhas de M. caesalpiniifolia, ativas contra o nematoide
Haemonchus contortus.
Material e métodos
O preparo do extrato e o teste anti-helmíntico foram realizados no Laboratório
de Controle de Parasitos (LCP), localizado no Centro de Ciências Biológicas e da
Saúde (CCBS) da Universidade Federal do Maranhão (UFMA). O fracionamento e a
análise por HPLC/UV-Vis foram executados no Laboratório de Química de Produtos
Naturais (LQPN), localizado no Centro de Ciências Exatas e Tecnologias (CCET) da
UFMA.
O material vegetal (folhas) foi coletado a partir de plantas adultas de
Mimosa caesalpiniifolia no Instituto Federal de Educação, Ciência e
Tecnologia do Maranhão (IFMA), campus Maracanã, São Luís. As folhas foram
higienizadas, secas à sombra, trituradas em uma forrageira, moídas em um moinho
de facas tipo Willey e peletizadas em uma peletizadora tipo Micro PelletMil 40
kg/h. 500 g de pellet foi extraído com acetona 70% (v/v), sonicado por 20 min em
banho-maria, filtrado, concentrado em rotaevaporador, liofilizado e armazenado a
4 °C. 1,54 g do extrato foi dissolvido em 6 mL de metanol 80% (v/v),
centrifugado (30.000 rpm; 10 min) e o sobrenadante foi carregado em uma
coluna cromatográfica embalada com Sephadex LH-20 (d=1,6 cm; h=40 cm) com
metanol como fase móvel. Frações de 7,5 mL foram coletadas e secas.
As frações foram dissolvidas em 1 mL de metanol 80% (v/v) e alíquotas de 25 μL
foram injetadas a partir de uma coluna Hypersil BDS C-18 (Thermo Electron Corp.,
Waltham, EUA) protegida por uma pré-coluna (Gemini C-18, Phenomenex, Torrance,
EUA) em um cromatógrafo líquido (Shimadzu Co., Kyoto, Japão) composto por um
degaseificador DGU-20A5, uma bomba LC-20AT, um controlador de sistema CBM-20A,
um detector de rede de fotodiodo SPD-M20A e o software LCsolution. As fases
móveis utilizadas foram ácido fórmico a 0,1% em água (A) e em metanol (B) em um
gradiente exploratório variando de 5% a 100% de B em 60 minutos a um fluxo de
1,0 mL/min. A temperatura da coluna foi mantida em 25 °C e o espectro UV-Vis foi
monitorado em 254 nm. Com base nos picos recorrentes entre as frações e na
identificação dos grupos químicos presentes, essas foram agrupadas e secas. A
identificação dos grupos químicos foi feita a partir da comparação dos tempos de
retenção e espectros de UV com dados da literatura.
As frações agrupadas foram diluídas em Tween 80 a 1,5% (v/v) e testadas conforme
Bahuaud et al. (2006) contra larvas de terceiro estágio (L3, infectantes)
de Haemonchus contortus. O desembainhamento artificial foi iniciado por
contato com solução de hipoclorito de sódio a 2,0% (w/v), interrompido em 0, 20,
40 e 60 min pela adição de solução de iodo de Lugol e larvas embainhadas e
desembainhadas foram contadas usando um microscópio invertido (Axio Vert, Zeiss,
Oberkochen, Alemanha). O teste foi realizado em quadruplicata. Para obtenção da
concentração inibitória mediana (CI50), os dados foram transformados
em log (x), normalizados e foi feita a regressão não linear a partir do software
GraphPad Prism 8.0 (GraphPad Inc., San Diego, EUA).
Resultado e discussão
A partir do fracionamento do extrato de folhas de M. caesalpiifolia em
coluna de Sephadex LH-20 obteve-se 63 frações. Com a análise destas por HPLC/UV
Vis e análises dos espectros na região do UV, foi possível obter 4 grupos
principais de frações (FRA-1, FRA-2, FRA-3 e FRA-4). O grupo de frações FRA-1
apresentou perfis característicos de tanino hidrolisável (Figura 1a), enquanto o
grupo FRA-2 apresentou característica de taninos condensados (Figura 1b). As
últimas, em que foram detectados picos de menor absorbância, foram divididas e
agrupadas em FRA-3 e FRA-4 (Figura 1c e 1d, respectivamente).
A atividade in vitro contra H. contortus foi avaliada por um
ensaio de inibição do desembainhamento larval a partir de larvas de terceiro
estágio (L3) do nematoide. Esse teste apresenta vantagens em relação a outros
bioensaios por ser sensível, reprodutível e relevante para processos que ocorrem
in vivo. Além disso, prevenir a perda da bainha em larvas de H.
contortus quebra o ciclo de vida larval (BAHUAUD et al., 2006) e não
permite o estabelecimento de uma infecção no hospedeiro (SOARES et al.,
2015). A amostra FRA-2 inibiu, mesmo na menor concentração testada, o
desembainhamento larval (Figura 2a), com IC50 de 0,21
mg.mL-1 (IC95% = 0,20 – 0,23; R2 = 0,98). A
amostra FRA-1 também inibiu o desembainhamento larval, porém em concentrações
mais altas (Figura 2b), com IC50 de 0,81 mg.mL-1
(IC95% = 0,72 – 0,92; R2 = 0,93). Em contraste, a maioria
das larvas desembainharam mesmo na maior concentração testada quando o
tratamento foi feito com FRA-3 e FRA-4 (Figura 2c e 2d), não apresentando dessa
forma uma atividade anti-helmíntica relevante o que, certamente, está atrelado
ao fato dessas frações serem agrupamentos das últimas alíquotas coletadas na gel
filtração o que indica que os compostos fenólicos responsáveis pela atividade já
haviam sido eluidos nas frações anteriores.
Sabe-se que taninos de diferentes plantas apresentam atividade contra nematoides
já relatada tanto in vitro quanto in vivo (CENCI et al.,
2007; DEBELA et al., 2012; ENGSTRÖM et al., 2016; KARONEN et
al., 2020; LIMA et al., 2019). O modo de ação dos taninos contra
nematoides gastrointestinais permanece amplamente debatido, com duas hipóteses
geralmente apontadas (ATHANASIADOU et al., 2001; HOSTE et al.,
2006; KAHN; DIAZ-HERNANDEZ, 1999; MARTÍNEZ-ORTÍZ-DE-MONTELLANO et al.,
2010). A primeira sugere que os taninos são capazes de formar complexos e criar
interações com proteínas do parasito, sendo apoiada pela maioria dos resultados
in vitro e por alguns estudos in vivo de curto prazo (ATHANASIADOU
et al., 2001; TZAMALOUKAS et al., 2006). Por outro lado, a segunda
hipótese sugere que os taninos podem afetar indiretamente a biologia do
nematoide por meio de uma melhora na resposta imune do hospedeiro (HOSTE et
al., 2006; KAHN; DIAZ-HERNANDEZ, 1999).
Nessa perspectiva, tendo como espécie alvo do estudo a M.
caelsapiniifolia, Brito et al. (2017) demonstrou que o extrato
cetônico de suas folhas tem uma significativa atividade sobre o desembainhamento
de uma mistura de larvas de H.contortus e Trichostrongylus
colubriformis com CI50 de 0,684 mg.mL-1. Efeito esse
que foi atribuído a presença de uma considerável quantidade de taninos e, mais
especificadamente, de taninos condensados devido o extrato com
polivinilpolipirrolidona (PVPP), composto utilizado como inibidor de taninos e
glicosídeos de flavonóis (ALONSO-DÍAZ et al., 2008; DONER; BECARD; IRWIN,
1993), não ter apresentado atividade in vitro. Em concordância, FRA-2,
que é o agrupamento de frações com picos indicativos de taninos condensados
(Figura 1b), apresentou a maior atividade dentre as frações testadas, com uma
CI50 cerca de três vezes menor do que a obtida por Brito et al.
(2017) para o extrato bruto.
No entanto, o PVPP também é capaz de se ligar e inativar outros vários
polifenóis (ALONSO-DÍAZ et al., 2008; BARRAU et al., 2005;
MENGISTU et al., 2017), incluindo ácidos fenólicos e seus derivados. Os
ácidos fenólicos são as unidades básicas de taninos hidrolisáveis e, embora
tenham sido pouco investigados quanto a atividade anti-helmíntica, já foram
apontados em estudos anteriores como tendo essa atividade (GAO et al.,
2018; LOPES et al., 2018; NDJONKA et al., 2014; PEGARD et al.
, 2005; SANTHI et al., 2019). Entre esses, o ácido gálico, o elágico,
o gentísico, o vanílico, o felúrico, o salicílico, o cinâmico e o clorogênico
são alguns dos compostos mencionados como anti-helmínticos. Já seus derivados
como derivados simples do ácido gálico, galotaninos e elagitaninos, que são
taninos que não têm sido tão exaustivamente estudados quanto os condensados,
também já demonstraram ter atividade anti-helmíntica, inclusive contra o H.
contortus (ENGSTRÖM et al., 2016; KARONEN et al., 2020).
Assim, corroborando com esses trabalhos, a amostra FRA-1, que é o agrupamento
das frações com um pico indicativo de tanino hidrolisável, derivado de ácido
fenólico, demonstrou ter atividade anti-helmíntica, porém com uma
CI50 maior do que a obtida para o extrato bruto por Brito et al.
(2017).
Todavia, novos estudos devem ser realizados para verificar detalhadamente quais
moléculas de fato estão atuando contra o desembainhamento do Haemonchus
contortus nas frações bioativas.
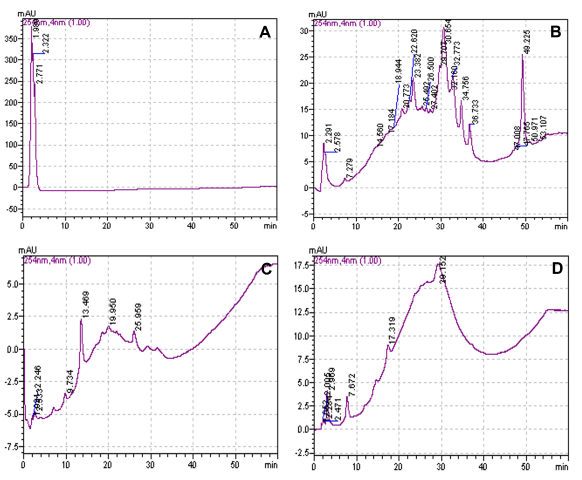
Cromatogramas HPLC/UV-Vis (254 nm) com os picos característicos do agrupamento de (a) FRA-1, (b) FRA-2, (c) FRA-3 e (d) FRA-4.
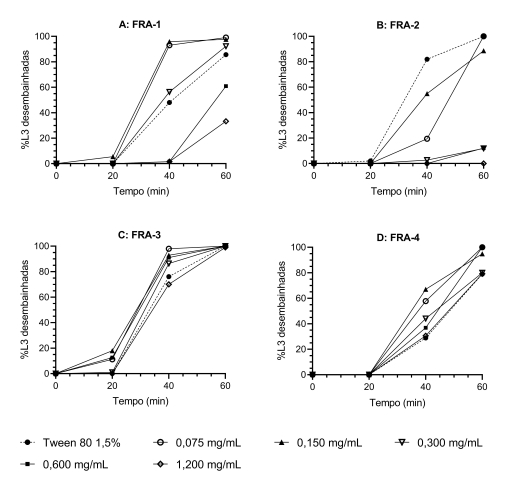
Efeito de (a) FRA-1, (b) FRA-2, (c) FRA-3 e (d) FRA- 4 no desembainhamento artificial de larvas de terceiro estágio (L3) de Haemonchus contortus.
Conclusões
A partir do presente estudo é possível inferir que frações enriquecidas com
polifenóis obtidas do fracionamento do extrato de folhas de Mimosa
caesalpiniifolia apresentam bioatividade e o potencial do extrato bruto pode estar
associado tanto a taninos condensados como hidrolisáveis. Somado a isso, foi
confirmado o potencial promissor do uso da M. caesalpiniifolia como fonte de
compostos fenólicos com atividade contra Haemonchus contortus, uma vez que as
frações agrupadas e identificadas como bioativas demonstraram ter uma alta
eficiência na inibição da perda da bainha em larvas infectantes desse nematoide,
com concentração inibitória mediana (CI50) abaixo de 1 mg.mL-1.
Agradecimentos
Agradecemos à FAPEMA, CNPq, CAPES, FINEP e IFMA.
Referências
ALONSO-DÍAZ, M. A.; TORRES-ACOSTA, J. F.; SANDOVAL-CASTRO, C. A.; CAPETILLO-LEAL, C.; BRUNET, S. et al. Effects of four tropical tanniniferous plant extracts on the inhibition of larval migration and the exsheathment process of Trichostrongylus colubriformis infective stage. Vet Parasitol, 153, n. 1-2, p. 187-192, 2008.
ATHANASIADOU, S.; KYRIAZAKIS, I.; JACKSON, F.; COOP, R. L. Direct anthelmintic effects of condensed tannins towards different gastrointestinal nematodes of sheep: in vitro and in vivo studies. Vet Parasitol, 99, n. 3, p. 205-219, 2001.
BAHUAUD, D.; MARTINEZ-ORTIZ DE MONTELLANO, C.; CHAUVEAU, S.; PREVOT, F.; TORRES-ACOSTA, F. et al. Effects of four tanniferous plant extracts on the in vitro exsheathment of third-stage larvae of parasitic nematodes. Parasitology, 132, n. 4, p. 545-554, 2006.
BARRAU, E.; FABRE, N.; FOURASTE, I.; HOSTE, H. Effect of bioactive compounds from Sainfoin ( Onobrychis viciifolia Scop.) on the in vitro larval migration of Haemonchus contortus: role of tannins and flavonol glycosides. Parasitology, 131, n. 4, p. 531-538, 2005.
BESIER, R. B.; KAHN, L. P.; SARGISON, N. D.; VAN WYK, J. A. The Pathophysiology, Ecology and Epidemiology of Haemonchus contortus Infection in Small Ruminants. Adv Parasitol, 93, p. 95-143, 2016.
BRITO, D.; COSTA JUNIOR, L. M.; GARCIA, J.; LOPES, S.; SANTOS, G. C. D. O. et al. In vitro action of Mimosa caesalpinifolia ketone extract on Haemonchus contortus and Trichostrongylus colubriformis. Semina: Ciências Agrárias, 38, n. 4, p. 1963-1971, 2017.
BRITO, D. R. B.; COSTA-JÚNIOR, L. M.; GARCIA, J. L.; TORRES-ACOSTA, J. F. J.; LOUVANDINI, H. et al. Supplementation with dry Mimosa caesalpiniifolia leaves can reduce the Haemonchus contortus worm burden of goats. Vet Parasitol, 252, p. 47-51, 2018.
CENCI, F. B.; LOUVANDINI, H.; MCMANUS, C. M.; DELL'PORTO, A.; COSTA, D. M. et al. Effects of condensed tannin from Acacia mearnsii on sheep infected naturally with gastrointestinal helminthes. Vet Parasitol, 144, n. 1-2, p. 132-137, 2007.
DEBELA, E.; TOLERA, A.; EIK, L. O.; SALTE, R. Condensed tannins from Sesbania sesban and Desmodium intortum as a means of Haemonchus contortus control in goats. Trop Anim Health Prod, 44, n. 8, p. 1939-1944, 2012.
DONER, L. W.; BECARD, G.; IRWIN, P. L. Binding of flavonoids by polyvinylpolypyrrolidone. Journal of Agricultural and Food Chemistry, 41, n. 5, p. 753-757, 1993.
ENGSTRÖM, M. T.; KARONEN, M.; AHERN, J. R.; BAERT, N.; PAYRÉ, B. et al. Chemical Structures of Plant Hydrolyzable Tannins Reveal Their in Vitro Activity against Egg Hatching and Motility of Haemonchus contortus Nematodes. Journal of Agricultural and Food Chemistry, 64, n. 4, p. 840-851, 2016.
GAO, X.; ZHANG, S.; ZHAO, X.; WU, Q. Potassium-induced plant resistance against soybean cyst nematode via root exudation of phenolic acids and plant pathogen-related genes. PLoS One, 13, n. 7, p. e0200903, 2018.
GARCÍA, J. E.; GÓMEZ, L.; MENDOZA-DE-GIVES, P.; RIVERA-CORONA, J. L.; MILLÁN-OROZCO, J. et al. Anthelmintic efficacy of hydro-methanolic extracts of Larrea tridentata against larvae of Haemonchus contortus. Tropical Animal Health and Production, 50, n. 5, p. 1099-1105, 2018.
HOSTE, H.; JACKSON, F.; ATHANASIADOU, S.; THAMSBORG, S. M.; HOSKIN, S. O. The effects of tannin-rich plants on parasitic nematodes in ruminants. Trends Parasitol, 22, n. 6, p. 253-261, 2006.
JACKSON, F.; VÁRADY, M.; BARTLEY, D. Managing anthelmintic resistance in goats Can we learn lessons from sheep? J Small Ruminant Research, 103, p. 3-9, 2012.
KAHN, L.; DIAZ-HERNANDEZ, A. Tannins with Anthelmintic Properties. In. 1 ed.: Brown Prior Anderson, 1999. p. 130-139.
KARONEN, M.; AHERN, J. R.; LEGROUX, L.; SUVANTO, J.; ENGSTRÖM, M. T. et al. Ellagitannins Inhibit the Exsheathment of Haemonchus contortus and Trichostrongylus colubriformis Larvae: The Efficiency Increases Together with the Molecular Size. J Agric Food Chem, 68, n. 14, p. 4176-4186, 2020.
KLONGSIRIWET, C.; QUIJADA, J.; WILLIAMS, A. R.; MUELLER-HARVEY, I.; WILLIAMSON, E. M. et al. Synergistic inhibition of Haemonchus contortus exsheathment by flavonoid monomers and condensed tannins. Int J Parasitol Drugs Drug Resist, 5, n. 3, p. 127-134, 2015.
LIMA, P. M. T.; CROUZOULON, P.; SANCHES, T. P.; ZABRÉ, G.; KABORE, A. et al. Effects of Acacia mearnsii supplementation on nutrition, parasitological, blood parameters and methane emissions in Santa Inês sheep infected with Trichostrongylus colubriformis and Haemonchus contortus. Exp Parasitol, 207, p. 107777, 2019.
LOPES, L. G.; SILVA, M. H.; FIGUEIREDO, A.; CANUTO, K. M.; BRITO, E. S. et al. The intake of dry cashew apple fiber reduced fecal egg counts in Haemonchus contortus-infected sheep. Exp Parasitol, 195, p. 38-43, 2018.
MARTÍNEZ-ORTÍZ-DE-MONTELLANO, C.; VARGAS-MAGAÑA, J. J.; CANUL-KU, H. L.; MIRANDA-SOBERANIS, R.; CAPETILLO-LEAL, C. et al. Effect of a tropical tannin-rich plant Lysiloma latisiliquum on adult populations of Haemonchus contortus in sheep. Vet Parasitol, 172, n. 3-4, p. 283-290, 2010.
MENGISTU, G.; HOSTE, H.; KARONEN, M.; SALMINEN, J. P.; HENDRIKS, W. H. et al. The in vitro anthelmintic properties of browse plant species against Haemonchus contortus is determined by the polyphenol content and composition. Vet Parasitol, 237, p. 110-116, 2017.
NDJONKA, D.; ABLADAM, E. D.; DJAFSIA, B.; AJONINA-EKOTI, I.; ACHUKWI, M. D. et al. Anthelmintic activity of phenolic acids from the axlewood tree Anogeissus leiocarpus on the filarial nematode Onchocerca ochengi and drug-resistant strains of the free-living nematode Caenorhabditis elegans. J Helminthol, 88, n. 4, p. 481-488, 2014.
OLIVEIRA, L.; BEVILAQUA, C.; MACEDO, I.; MORAIS, S.; MONTEIRO, V. et al. Effect of six tropical tanniferous plant extracts on larval exsheathment of Haemonchus contortus. Braz J Vet Parasitol, 20, p. 155-160, 2011.
PAOLINI, V.; BERGEAUD, J. P.; GRISEZ, C.; PREVOT, F.; DORCHIES, P. et al. Effects of condensed tannins on goats experimentally infected with Haemonchus contortus. Vet Parasitol, 113, n. 3-4, p. 253-261, 2003.
PARKINS, J. J.; HOLMES, P. H. Effects of Gastrointestinal Helminth Parasites on Ruminant Nutrition. Nutrition Research Reviews, 2, n. 1, p. 227-246, 1989.
PEGARD, A.; BRIZZARD, G.; FAZARI, A.; SOUCAZE, O.; ABAD, P. et al. Histological Characterization of Resistance to Different Root-Knot Nematode Species Related to Phenolics Accumulation in Capsicum annuum. Phytopathology, 95, n. 2, p. 158-165, 2005.
PODADERA, D. S.; ENGEL, V. L.; PARROTTA, J. A.; MACHADO, D. L.; SATO, L. M. et al. Influence of Removal of a Non-native Tree Species Mimosa caesalpiniifolia Benth. on the Regenerating Plant Communities in a Tropical Semideciduous Forest Under Restoration in Brazil. Environmental Management, 56, n. 5, p. 1148-1158, 2015.
SALGADO, J.; SANTOS, C. Overview of anthelmintic resistance of gastrointestinal nematodes of small ruminants in Brazil. Braz J Vet Parasitol, 25, n. 1, p. 3-17, 2016.
SANTHI, V. S.; SALAME, L.; MUKLADA, H.; AZAIZEH, H.; HAJ-ZAROUBI, M. et al. Toxicity of phenolic compounds to entomopathogenic nematodes: A case study with Heterorhabditis bacteriophora exposed to lentisk (Pistacia lentiscus) extracts and their chemical components. J Invertebr Pathol, 160, p. 43-53, 2019.
ŠIMPRAGA, M.; LJUBIČIĆ, I.; HLEDE, J. P.; VUGROVEČKI, A. S.; MARINCULIĆ, A. et al. Alternative approaches for the control of gastrointestinal nematodes in sheep farming: a review. Berl Munch Tierarztl Wochenschr, 128, n. 7-8, p. 257-270, 2015.
SOARES, A. M. S.; DE ARAÚJO, S. A.; LOPES, S. G.; COSTA JUNIOR, L. M. Anthelmintic activity of Leucaena leucocephala protein extracts on Haemonchus contortus. Braz J Vet Parasitol, 24, n. 4, p. 396-401, 2015.
SOARES, A. M. S.; WANDERLEY, L. F.; COSTA JUNIOR, L. M. The potential of plant and fungal proteins in the control of gastrointestinal nematodes from animals. Braz J Vet Parasitol, 28, p. 339-345, 2019.
TZAMALOUKAS, O.; ATHANASIADOU, S.; KYRIAZAKIS, I.; HUNTLEY, J. F.; JACKSON, F. The effect of chicory ( Cichorium intybus ) and sulla ( Hedysarum coronarium ) on larval development and mucosal cell responses of growing lambs challenged with Teladorsagia circumcincta. Parasitology, 132, n. 3, p. 419-426, 2006.
WALLER, P. J. Sustainable helminth control of ruminants in developing countries. Vet Parasitol, 71, n. 2-3, p. 195-207, 1997.
WINK, M. Medicinal plants: a source of anti-parasitic secondary metabolites. Molecules, 17, n. 11, p. 12771-12791, 2012.
















