Autores
Cruz-martinez, Y.R. (INSTITUTO DE QUIMICA, UNAM) ; Hernandez, T. (FES-IZTACALA, UNAM) ; Valencia, I. (FES-IZTACALA, UNAM) ; Delgado, G. (INSTITUTO DE QUIMICA, UNAM)
Resumo
En la presente investigación se determinó la actividad antibacteriana y el efecto
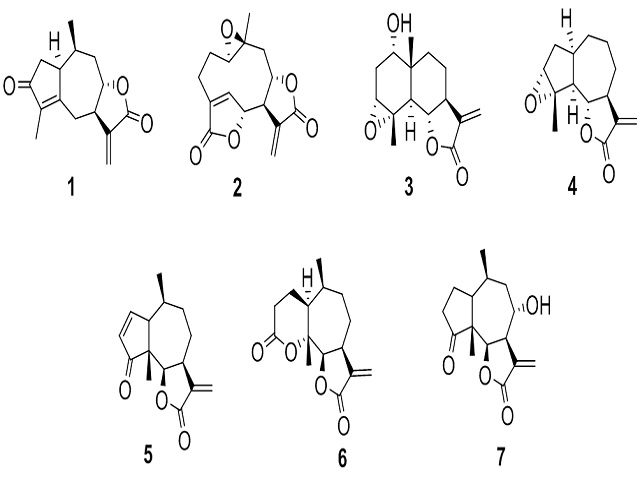
sensibilizador de las lactonas sesquiterpénicas (LS): xerantólida (1),
desoximikanólida (2), ludovicina A (3), estafiatina (4), ambrosina (5),
psilostaquina C (6) y desacetilconfertiflorina (7) en una cepa de Staphylococcus
aureus 23MR resistente a las cefalosporinas cefuroxima (CEFM) y cefepima (CPM),
utilizando el método de microdilución en caldo. La presencia de 100 μg/mL del
compuesto 5 incrementó la sensibilidad hacia la CEFM; mientras que la presencia de
la misma concentración de los compuestos 1, 2, 4 y 5 potenciaron la actividad de
la CPM hasta quince veces. La inhibición de la enzima β-lactamasa podría
considerarse como un posible mecanismo de sensibilización de resistencia.
Palavras chaves
sesquiterpenlactonas; sensibilizador; cefalosporinas
Introdução
Desde el descubrimiento de la penicilina por Alexander Fleming en 1928, muchos
antibióticos se han utilizado con éxito para el tratamiento de padecimientos
infecciosos (LOBANOVSKA et al., 2017). Sin embargo, diversos factores han
promovido la aparición de patógenos resistentes, los cuales, se han convertido
en una amenaza de salud a nivel global (KLEIN et al., 2018). De acuerdo con la
Organización Mundial de la Salud (OMS) se proyecta que hacia el 2050 ocurran
aproximadamente 10 millones de defunciones cada año a causa de infecciones no
tratadas adecuadamente (WHO, 2020).
Considerando la propagación acelerada de bacterias resistentes y la disminución
de esfuerzos en la investigación y el desarrollo de nuevos antibióticos, se hace
pertinente la búsqueda de alternativas que permitan contrarrestar estos
microorganismos. En este sentido, en la literatura se reconocen diferentes
estrategias (TINOUSH et al., 2020), sin embargo, la que compete al presente
proyecto de investigación, es la utilización de productos naturales (PNs)
aislados de plantas en combinación con antibióticos ya conocidos con el objetivo
de incrementar su efectividad.
Por otra parte, de acuerdo con la información referente a las plantas en México,
la familia Asteraceae es una de las más reconocidas, ya que cuenta con un gran
número de géneros y especies (VILLASEÑOR 2018). En la literatura se indica que
las plantas de esta familia biosintetizan diversidad de compuestos como
poliacetilenos, fenoles, esteroles y terpenoides; sin embargo, las lactonas
sesquiterpénicas (LS) son los compuestos que mejor la caracterizan. En la
búsqueda de compuestos de interés para la salud humana, las LS han mostrado
diversas propiedades biológicas entre las que destacan la actividad antifúngica,
analgésica, antiprotozoaria, citotóxica, antiinflamatoria, entre otras (CHADWICK
et al., 2013).
Por lo tanto, para contribuir con el conocimiento de las propiedades biológicas
de este grupo de PNs, el objetivo de la presente investigación fue determinar la
actividad antibacteriana de las LS: xerantólida (1), desoximikanólida (2),
ludovicina A (3), estafiatina (4), ambrosina (5), psilostaquina C (6) y
desacetilconfertiflorina (7) (Figura 1) en una cepa resistente de importancia
clínica: Staphylococcus aureus 23MR, así como evaluar su capacidad para
incrementar la sensibilidad de dicho microorganismo hacia los efectos de los
antibióticos cefuroxima (CEFM) y cefepima (CPM). Finalmente, para dilucidar un
posible mecanismo de sensibilización, se propuso realizar estudios de
acoplamiento molecular con la enzima β-lactamasa, la cual está involucrada
principalmente con los mecanismos de resistencia a este grupo de antibióticos
(VRANCIANU et al., 2020).
Material e métodos
Productos naturales: mediante métodos cromatográficos convencionales se
purificaron las lactonas sesquiterpénicas: 1 y 2, 3 y 4, 5, 6 y 7, de partes
aéreas de las especies vegetales Mikania micrantha, Artemisia ludoviciana,
Parthenium incanum y Ambrosia confertiflora, respectivamente. La identificación
de los compuestos se realizó por comparación de las propiedades físicas y los
datos espectroscópicos de RMN de 1H y 13C con los informados en la literatura.
Ensayos de actividad biológica: se utilizó una cepa bacteriana de Staphylococcus
aureus 23MR resistente a cefuroxima (CEFM) y cefepima (CPM) proporcionados por
la Clínica Universitaria de la Salud Integral (CUSI) de la Facultad de Estudios
Superiores Iztacala. La cepa se mantuvo en agar Müller-Hinton y se subcultivó
dos veces previo a los ensayos. Para la obtención de la Concentración Mínima
Inhibitoria (CMI) y Concentración Mínima Bactericida (CMB) de los productos
naturales (PNs) y antibióticos, se utilizó el método de microdilución en caldo
(CLSI, 2021); como control positivo de actividad antibacteriana se incorporó
cloranfenicol a 25 μg/mL. Respecto a los ensayos de sensibilización de
resistencia, se determinó la CMI de CEFM y CPM en presencia de 100 μg/mL de los
compuestos 1-7. En dichos estudios se incluyó al ácido clavulánico como control
positivo de sensibilización a una concentración de 25 μg/mL. El efecto
sensibilizador se informó como un factor de reversión obtenido a partir de la
siguiente fórmula: CMI antibiótico/ CMI del antibiótico en presencia del PN.
Estudios de acoplamiento molecular con la enzima β-lactamasa: la estructura
cristalina de la β-lactamasa de S. aureus se obtuvo del Banco de Datos de
Proteínas con código 1BLC. La estructura tridimensional de las LS se descargó de
la base de datos PubChem. La preparación de las proteínas y los ligandos en los
formatos requeridos se realizó utilizando la herramienta virtual Pyrx (DALLAKYAN
et al., 2015). Para los cálculos de acoplamiento molecular se utilizó el
software AMDock (VALDÉS et al., 2020). La visualización de las interacciones
proteína-ligando fueron posibles con el software Discovery Studio 2020
(DASSAULT, 2019) así como PyMOL2 (SEELINGER et al., 2010).
Resultado e discussão
El estudio químico de diferentes plantas de la familia Asteraceae permitió la
purificación de las lactonas sesquiterpénicas (LS) 1-7 (Figura 1). Las cuales se
evaluaron
frente a una cepa de Staphylococcus aureus resistente a los antibióticos
cefuroxima (CEFM) y cefepima (CPM). Los resultados de actividad antibacteriana
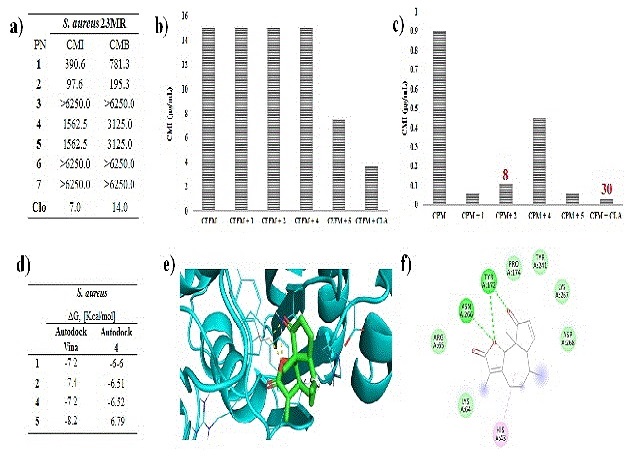
de todos los compuestos se presentan en la Figura 2a, en la cual se pueden
observar Concentraciones Mínimas Inhibitorias (CMIs) en un rango de 97.6 hasta >
6250 μg/mL, siendo la desoximikanólida (2) la que mostró el valor más bajo,
seguida de xerantólida (1), estafiatina (4) y ambrosina (5); sin embargo,
ninguno de los PNs superó la actividad del control (cloranfenicol). En un
estudio previo se informó la actividad antibacteriana del compuesto 2 en una
cepa sensible de S. aureus en donde se obtuvo una CMI de 62.5 mg/mL (YAN LI et
al., 2013). Sin embargo, para el resto de los compuestos no se encontró
información al respecto, por lo que la presente investigación provee de dicho
conocimiento.
Continuando con la exploración de las actividades biológicas, se realizaron los
bioensayos de sensibilización, en los cuales se determinaron las CMIs de los
antibióticos CEFM (CMI = 15 μg/mL) y CPM (CMI = 0.9 μg/mL) en presencia de una
concentración subinhibitoria (100 μg/mL) de las LS 1-7, con el objetivo de
monitorear algún cambio en el valor de la CMI respecto a los obtenidos para los
fármacos solos. Los resultados de dichos bioensayos se presentan en la Figura
2b, en donde se puede observar que únicamente la presencia de la ambrosina (5)
incrementó la sensibilidad de la cepa bacteriana hacia la CEFM al reducir el
valor de la CMI de 15 a 7.5 μg/mL. Por otra parte, en la Figura 2c se observa
que los compuestos 1, 2, 4 y 5, incrementaron la sensibilidad hacia la CPM. La
xerantólida (1) y la ambrosina (5) fueron las que mostraron el mejor efecto
sensibilizador al disminuir quince veces la CMI del antibiótico desde 0.9 a 0.06
μg/mL. Por su parte, la desoximikanólida (2) redujo ocho veces la CMI de CPM
desde 0.9 a 0.11 μg/mL. De acuerdo con la información en la literatura, la
actividad de las LS puede atribuirse principalmente a la presencia del grupo α-
metilen-γ-lactona que puede formar interacciones con diversos blancos
moleculares (CHADWICK et al., 2013). El menor efecto sensibilizador observado
para la germacranólida 2 comparado con el de las guayanólidas 1 y 5 puede estar
mediado por sus características estructurales, el compuesto 2 presenta poca
estabilidad debido al grupo epóxido en la posición 1(10) que tiende a reaccionar
con la olefina en 4(5).
Por otra parte, los estudios de acoplamiento molecular entre la β-lactamasa de
S. aureus y las LS 1, 2, 4 y 5, generaron los resultados que se muestran en la
Figura 2d. La ambrosina (5) mostró la mayor energía de unión con un valor de
-8.2 y -6.79 kcal/mol utilizando Autodock Vina y Autodock 4, respectivamente. La
interacción entre la enzima y el PN puede observarse en la Figura 2e.
Finalmente, en la Figura 2f se muestra principalmente la formación de puentes de
hidrógeno entre el oxígeno de la lactona con el residuo de Asn 266 y Tyr 172 así
como otra interacción entre el carbonilo en C4 con el residuo de Tyr 172. Los
valores de las energías de unión obtenidas para cada compuesto están definidos
por sus diferencias estructurales. La presencia de carbonilos α,β insaturados en
este grupo de PNs permite la formación de enlaces de mayor estabilidad.
Estructuras químicas de los productos naturales evaluados en los bioensayos
Resultados de actividad antibacteriana, efecto sensibilizador y estudios in silico
Conclusões
La presente investigación contribuye al conocimiento de la actividad
antibacteriana de las lactonas sesquiterpénicas: xerantólida (1), desoximikanólida
(2), ludovicina A (3), estafiatina (4), ambrosina (5), psilostaquina C (6) y
desacetilconfertiflorina (7) frente a una cepa de S. aureus resistente.
Los compuestos 1, 2, 4 y 5 potencian la actividad de los antibióticos cefuroxima y
cefepima, por lo que podrían ser considerados para investigaciones adicionales
como sensibilizadores de patógenos resistentes en búsqueda de alternativas
terapéuticas para el tratamiento de padecimientos infecciosos no tratables.
Los cálculos de acoplamiento molecular sugieren que la inhibición de la enzima β-
lactamasa es uno de los posibles mecanismos de sensibilización de la resistencia
de la cepa bacteriana en estudio.
Agradecimentos
Al personal técnico académico del Instituto de Química, UNAM. Al laboratorio de
Bioactividad de Productos Naturales de la FES-Iztacala. Al Proyecto UNAM-DGAPA-
PAPIIT (IG200821). Al CONACyT por la beca otorgada, becario: 620162.
Referências
BLAIR, J.M.; WEBBER, M.; BAYLAY, A.; OGBOLU, D.; PIDDOCK, L. Molecular mechanisms of antibiotic resistance. Nature Reviews, 13, 42-51, 2015. doi: 10.1038/nrmicro3380.
CHADWICK, M.; TREWIN, T.; GAWTHROP, F.; WAGSTAFF, C. Sesquiterpenoids Lactones: Benefits to Plants and People. International Journal of Molecular Sciences, 14, 12780-12805, 2013. doi: 10.3390/ijms140612780.
CLINICAL AND LABORATORY STANDARS INSTITUTE (CLSI). Performance Standars for Antimicrobial Susceptibility Testing. 27 th ed. CLSI supplement M100, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA, 2017.
DALLAKYAN S, OLSON AJ. Detección de bibliotecas de moléculas pequeñas mediante acoplamiento con PyRx. Biology Methods and Protocols, 1263:243–250, 2015. doi:10.1007/978-1-4939-2269-7_19.
DASSAULT B.D.S.V. Dassault Systèmes BIOVIA; San Diego, CA, USA: 2019. Systèmes BIOVIA, Version 2019.
KLEIN, E.Y.; VAN BOECKEL, T.P.; MARTINEZ, E.; PANT, SD.; GANDRA, S.; LEVIN, S.; GOOSSENS, H.; LAXMINARAYAN, R. Global increase and geographic convergence in antibiotic consumption between 2000 and 2015. Proceedings of the National Academy of Sciences, 115: E3463-E3470, 2018. doi: 10.1073/pnas.1717295115.
LOBANOVSKA, M.; PILLA, G. Penicillin's Discovery and Antibiotic Resistance: Lessons for the Future? Yale Journal of Biology and Medicine, 29; 90(1):135-145, 2017. PMID: 28356901.
SEELIGER, D., DE GROOT, B.L. Ligand docking and binding site analysis with PyMOL and Autodock/Vina. Journal of Computer-Aided Molecular Design, 24(5), 417–422, 2010. doi: 10.1007/s10822-010-9352-6.
TINOUSH, B.; SHIRDEL, I.; WINK, M. Phytochemicals: Potential Lead Molecules for MDR Reversal. Frontiers in Pharmacology, 11:832, 2020. doi: 10.3389/fphar.2020.
VALDÉS-TRESANCO, M.S., VALDÉS-TRESANCO, M.E., VALIENTE, P.A. ET AL. AMDock: a versatile graphical tool for assisting molecular docking with Autodock Vina and Autodock4. Biology Direct, 15, 12, 2020. doi:10.1186/s13062-020-00267-2
VILLASEÑOR, J.L. Diversidad y distribución de la familia Asteraceae en México. Botanical Sciences, 96, 332-358, 2018. doi: 10.17129/botsci.1872.
VRANCIANU, C. O.; GHEORGHE, I.; DOBRE, E. G.; BARBU, I. C.; CRISTIAN, R. E.; POPA, M.; LEE, S. H.; LIMBAN, C.; VLAD, I. M.; CHIFIRIUC, M. C. Emerging Strategies to Combat β-Lactamase Producing ESKAPE Pathogens. International Journal of Molecular Sciences, 21(22), 8527, 2020. doi: 10.3390/ijms21228527.
WORLD HEALTH ORGANIZATION (2021). Resistencia a los antimicrobianos. Recuperado de: https://www.who.int/es/news-room/fact-sheets/detail/antimicrobial-resistance
















