Autores
Pérez-valera, O. (INSTITUTO DE QUÍMICA, UNAM) ; Espinosa-garcía, F. (ENES-MORELIA, UNAM) ; Delgado, G. (INSTITUTO DE QUÍMICA, UNAM)
Resumo
El estudio químico de Diospyros xolocotzii (zapote prieto) tiene el objetivo de
generar conocimiento científico sobre el contenido metabólico de partes aéreas y
corteza de esta especie vegetal, así como integrar a las sustancias aisladas
dentro de una base de datos de metabolitos secundarios aislados a partir del
género Diospyros, y mediante herramientas quimioinformáticas contextualizarlas
dentro del espacio químico de sustancias antifúngicas informadas en la inhibición
de hongos fitopatógenos con la finalidad de contribuir en la búsqueda de
candidatos moleculares con potencial antifúngico dentro de este grupo de plantas.
Palavras chaves
Zapote; Triterpenos; Naftoquinonas
Introdução
El aprovechamiento de los productos naturales como plaguicidas se ha realizado
desde la antigüedad; el uso de Tanacetum cinerariaefolium (Asteraceae) como
insecticida se conoce desde el año 400 A.C; a finales del siglo XVII se dio a
conocer a la nicotina, asilada de Nictotiana tabacum (Solanaceae), como el
primer insecticida puro de origen natural (GONZALEZ-COLOMA et al., 2006). La
estrobilurina A, una sustancia antifúngica aislada del hongo Strobilurus
tenacellus, ha servido de inspiración en la semisíntesis del derivado
azoxiestrobina, el cual es uno de los antifúngicos más vendidos a nivel mundial
en el sector agrícola (RIMANDO & DUKE, 2006).
El género Diospyros (Ebenaceae) está constituido por aproximadamente 500
especies vegetales. A partir de este grupo de plantas se ha informado el
aislamiento de triterpenos pentacíclicos, saponinas, naftoquinonas, cumarinas,
flavonoides, entre otros (RAUF et al., 2017). En el contexto de la actividad
plaguicida existen reportes sobre la actividad antitermítica de naftoquinonas
procedentes de la raíz de D. sylvatica (GANAPATY et al., 2004), así como la
actividad de sustancias aisladas a partir de D. virginiana sobre los hongos
fitopatógenos Phomopsis obscurans y P. vitícola (WANG et al., 2011).
Recientemente se dio a conocer la actividad antifúngica de extractos de hojas de
D. cuneata sobre Colletotrichum gloeosporioides (SULUB-TUN et al., 2020),
microorganismo causante de la antracnosis en frutas. Sin embargo, la
investigación sobre la búsqueda de sustancias plaguicidas y en específico de
sustancias antifúngicas aisladas del género Diospyros es un área del
conocimiento poco explorada.
En México existen 20 especies nativas de Diospyros (DIAZ et al., 2015). D.
xolocotzii (zapote prieto) es una especie de zapote silvestre localizada en los
estados de Michoacán y Guanajuato. Esta especie no solo es de interés
alimentario y medicinal, sino también ecológico y de conservación, pues quedan
relativamente pocos individuos de D. xolocotzii en las poblaciones donde se le
conoce.
El objetivo de este trabajo es generar conocimiento científico sobre los
constituyentes químicos de la especie D. xolocotzii, mediante (a) la realización
un análisis teórico a partir de la creación de una base de datos de metabolitos
secundarios presentes en el género Diospyros, (b) llevar a cabo un análisis de
ordenación con respecto a sustancias antifúngicas de origen natural y sintético
probadas contra cepas de hongos fitopatógenos, (c) la predicción de su
probabilidad de actividad antifúngica mediante el algoritmo de predicción del
espectro de actividad para substancias, PASS online (LAGUNIN et al., 2000), y
(d) correlacionar los resultados obtenidos a partir del análisis teórico con los
metabolitos secundarios aislados de D. xolocotzii.
Material e métodos
Materiales y métodos
Estudio químico de D. xolocotzii. Se colectaron partes aéreas y corteza de la
especie vegetal D. xolocotzii en el municipio de Acámbaro, Guanajuato, México.
Se prepararon extractos CH2Cl2:MeOH (1:1) de hojas, ramas y corteza de esta
especie. El aislamiento de los constituyentes químicos se realizó mediante
procedimientos cromatográficos convencionales y la elucidación estructural se
determinó por medio de técnicas espectroscópicas, espectrométricas, así como por
comparación con datos informados en la literatura científica.
Estudio quimioinformático
a) Creación de una base de datos de sustancias aisladas de especies del
género Diospyros. A partir de una revisión en la literatura científica
disponible en las plataformas PubChem, Reaxys y Scifinder se integró una base de
datos de 200 metabolitos secundarios aislados a partir de diferentes especies
del género Diospyros. La biblioteca se organizó en los siguientes rubros: a)
especie, b) nombre común del metabolito, c) nombre IUPAC, d) familia química del
metabolito secundario, e) parte de la planta de la cual se aisló, f) formato de
Sistema de Introducción Lineal Molecular Simplificado (SMILES), y g) referencia
bibliográfica.
b) Estudio teórico de sustancias aisladas de Diospyros contra sustancias
antifúngicas. A partir de la base de datos libre CheMBL se descargó el formato
SMILES de 700 sustancias antifúngicas probadas contra los hongos fitopatógenos
C. gloeosporioides, Fusarium oxysporum y F. graminearum, esta subbase de datos
se importó al programa Data Warrior junto con la base de datos creada de
sustancias aisladas de Diopsyros en un formato .csv. Posteriormente se
calcularon parámetros fisicoquímicos utilizados en la búsqueda de sustancias con
actividad plaguicida (AVRAM et al., 2014), los cuales fueron: a) peso molecular,
b) número de átomos donadores de enlace de hidrógeno (#DEH), c) número de átomos
aceptores de enlace de hidrógeno (#AEH), d) número de enlaces rotables (#ER), e)
área topológica polar superficial (ATPS), f) coeficiente de reparto octanol-agua
(cLog P) y e) número de enlaces aromáticos (#EA). Por último, utilizando el
programa Data Warrior se realizó un análisis de componentes principales (ACP) en
función de las propiedades fisicoquímicas calculadas con el objetivo de
visualizar a las sustancias aisladas del género Diospyros dentro del entorno
químico de las sustancias antifúngicas.
c) Cálculo de la probabilidad de actividad antifúngica (Pa) mediante el
algoritmo de predicción del espectro de actividad para substancias PASS online.
Adicionalmente se realizó la predicción de la actividad antifúngica de los 200
metabolitos secundarios integrados en la base de datos de sustancias aisladas
del género Diospyros mediante el algoritmo PASS Online. El cálculo de la
probabilidad de actividad antifúngica fue realizado a partir del formato SMILES
generado para de cada uno de los compuestos presentes en la base de datos de
sustancias aisladas de Diospyros.
Resultado e discussão
A partir de los extractos de hojas, ramas y corteza de D. xolocotzii se aislaron
las substancias lupeol (1), betulina (2), ácido betulínico (3), bauerenol (4),
α-amirina (5), β-amirina (6), uvaol (7), ácido ursólico (8), β-sitosterol (9),
estigmasterol (10), β-D-glucósido de β-sitosterilo (11) e isodiospirina (12)
(Figura 1A).
De acuerdo con la literatura científica los triterpeno 2, 3 y 8 se aíslan
mayoritariamente de las hojas de este grupo de plantas (MALLAVADHANI et al.,
1998), lo cual es consistente con lo encontrado en D. xolocotzii,
específicamente el ácido ursólico (8) es el constituyente mayoritario de las
hojas de esta planta. Por otro lado, las naftoquinonas, consideradas, como los
marcadores quimio-taxonómicos de especies del género Diospyros, se distribuyen
mayoritariamente en las cortezas y raíces de estas plantas, sin embargo, en la
corteza de D. xolocotzii las sustancias mayoritarias fueron los triterpenos
lupeol (1), betulina (2) y ácido betulínico (3), mientras que la nafotquinona
isodiospirina (12) se aisló como un constituyente minoritario de la corteza.
Adicional al estudio químico de D. xolocotzii, se realizó el cálculo
probabilidad de actividad antifúngica (Pa) para los metabolitos secundarios
integrados en la base de datos de Diospyros. De acuerdo con dicho análisis, el
5.0 % de las sustancias aisladas de Diospyros presenta una Pa mayor a 0.7, es
decir, su probabilidad de presentar actividad antifúngica en un ensayo in vitro
es alta. Las sustancias que están integradas en este porcentaje corresponden a
sustancias glicosiladas como el glucósido de flavonoide clitorina (13) y la
kakisaponina III (14). En relación con las sustancias que se aislaron de la
especie D. xolocotzii, el β-D-glucopiranósido de β-sitosterilo (11) presenta una
Pa igual a 0.72 y sigue la tendencia que relaciona a las sustancias que
presentan altas probabilidades de actividad antifúngica con la presencia de
azúcares en su estructura molecular.
Por otro lado, el 58.0% de los metabolitos secundarios aislados de especies de
Diospyros presenta una probabilidad de actividad antifúngica moderada, ya que
oscilan entre 0.5<Pa<0.7. Los triterpenos aislados de D. xolocotzii lupeol (1),
betulina (2), ácido ursólico (8) y ácido betulínico (3), se encuentran dentro de
este porcentaje.
En el análisis de componentes principales (ACP) se visualizaron las sustancias
aisladas de especies del género Diospyros dentro del espacio químico de
sustancias antifúngicas. En la figura 2 se observa que las sustancias se ordenan
en dos grupos. En el grupo I convergen sustancias como la kakisaponina III (14)
y el ebenemariósido D (15), las cuales presentan las más altas probabilidades de
actividad antifúngica de sustancias aisladas de Diospyros ordenadas en este
grupo, Pa = 0.721 y Pa = 0.712, respectivamente. Estas sustancias se ordenan en
el espacio químico de algunos antifúngicos probados, como algunos derivados del
ácido cólico, los cuales degradan biopelículas fúngicas (GUPTA et al., 2021).
Las sustancias 1-11 aisladas a partir de D. xoloctozii también convergen en este
grupo y guardan semejanza estructural con 14 y 15, las cuales son saponinas con
esqueletos correlacionados con triterpenos de tipo ursano.
Por otro lado, en el grupo II se ordenan metabolitos secundarios como
naftoquinonas, flavonoides, antraquinonas, estas substancias tienen en común
presentar anillos aromáticos en su estructura molecular; en este grupo se ordena
el flavonoide clitorina (13), el cual fue aislado de las hojas de D. cathayensis
(FURUSAWA et al., 2005) y cuyo valor de probabilidad de actividad antifúngica es
el más alto de la base de datos, Pa = 0.8, y el cual converge en el espacio del
antibiótico Da2B (16), el cual es una antraciclina aislada de Actinomadura
roseola que inhibe a los hongos fitopatógenos Phytophtora capsici y Rhizoctonia
solani (KIM et al., 2000). Dentro de este grupo se ordena la naftoquinona
isodiospirina (12), aislada de D. xolocotzii, la cual presenta un valor de
probabilidad de actividad antifúngica moderado, Pa = 0.526. Existe una clara
tendencia respecto a la ordenación de las sustancias aisladas de especies del
género Diospyros y D. xolocotzii en función del cálculo de sus propiedades
fisicoquímicas; así como la presencia de azúcares en la estructura molecular es
un factor para considerar en la alta probabilidad de actividad antifúngica que
pueden presentar, aunque finalmente esta aproximación debe ser contrastada con
ensayos in vitro.
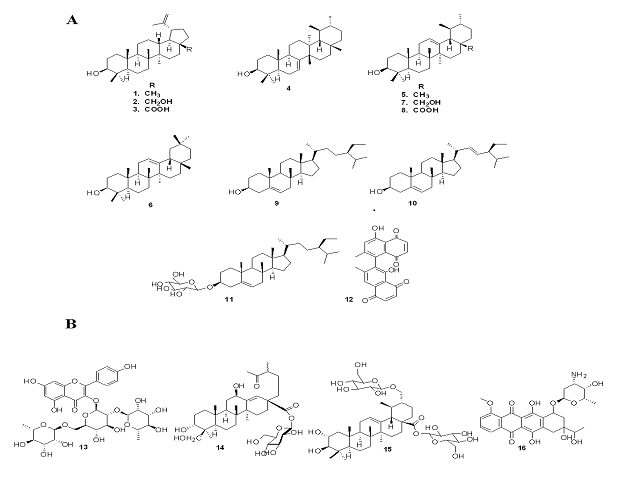
A. Sustancias aisladas de D. xolocotzii. B. Sustancias de interés en el ACP de la base de datos de Diopsyros contra sustancias antifúngicas.
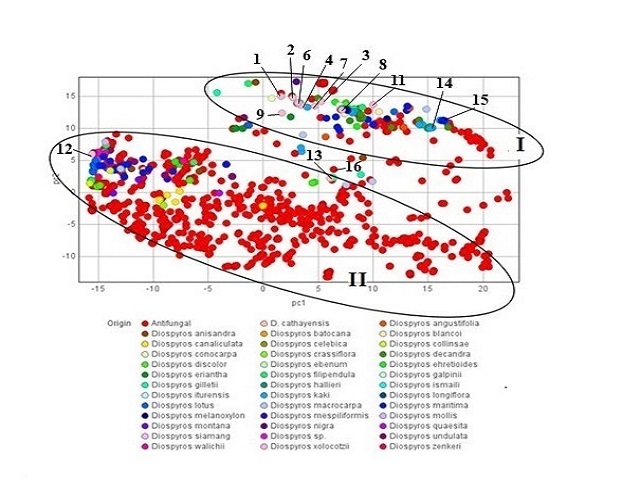
Análisis de componentes principales de sustancias aisladas de Diospyros visualizadas en el espacio químico de sustancias antifúngicas.
Conclusões
Mediante el uso de herramientas quimioinformáticas se encontró que dentro del
género Diospyros (Ebenaceae) existen candidatos moleculares con posible actividad
antifúngica, ya que dadas ciertas similitudes estructurales y tomando en cuenta
las propiedades fisicoquímicas de las sustancias, éstas se ordenan claramente en
dos grupos de candidatos.
Las sustancias glicosiladas presentes en la base de datos de metabolitos
secundarios aislados de Diospyros presentan los valores más altos de probabilidad
de actividad antifúngica.
En la especie vegetal D. xolocotzii se aislaron mayoritariamente triterpenos
pentacíclicos, que de acuerdo con el análisis quimioinformático su probabilidad en
actividad antifúngica en un ensayo in vitro se considera moderada.
Agradecimentos
Al personal técnico académico del Instituto de Química, UNAM. Al Ing. Daniel
Beltrán y al M. en C. Luis J. Romero Morán por la colecta del material vegetal. Al
CONACyT bajo el convenio 771691. Al Proyecto UNAM DGAPA-PAPIIT (AG200821).
Referências
AVRAM, S.; FUNAR-TIMOFEI, S.; BOROTA, A.; CHENNAMANENI, S.R.; MANCHALA, A.K.; MURESAN, S. Quantitative estimation of pesticide-likeness for agrochemical discovery. Journal of Cheminformatics v. 6, 1–11, 2014. https://doi.org/10.1186/s13321-014-0042-6
DÍAZ, R.G.; SÁNCHEZ, J.A.C.; LEDESMA, S.S.; PEÑA, F.B. Panbiogoegraphic analysis of Diospyros spp . (Ebenaceae) in Mexico Resumen Introducción. Revista Mexicana de Ciencias Agrícolas, 6, 187–200, 2015.
FURUSAWA, M.; TANAKA, T.; ITO, T.; NAKAYA, K.I.; ILIYA, I.; OHYAMA, M.; IINUMA, M.; MURATA, H.; INATOMI, Y.; INADA, A.; NAKANISHI, T.; MATSUSHITA, S.; KUBOTA, Y.; SAWA, R.; TAKAHASHI, Y. Flavonol glycosides in leaves of two Diospyros species. Chemical and Pharmaceutical Bullentin, v. 53, n. 5, 591–593, 2005. https://doi.org/10.1248/cpb.53.591
GANAPATY, S.; THOMAS, P.S.; FOTSO, S.; LAATSCH, H. Antitermitic quinones from Diospyros sylvatica. Phytochemistry, v. 65, 1265–1271, 2004. https://doi.org/10.1016/j.phytochem.2004.03.011
GONZALEZ-COLOMA, A.; REINA, M.; DIAZ, C.E.; FRAGA, B.M. Natural product-based biopesticides for insect control, Comprehensive Natural Products II: Chemistry and Biology. Elsevier Inc. 6-21, 2006. https://doi.org/10.1016/b978-008045382-8.00074-5
GUPTA, R.; THAKUR, J.; PAL, S.; MISHRA, D.; RANI, P.; KUMAR, S.; SAINI, A.; SINGH, A.; YADAV, K.; SRIVASTAVA, A.; PRASAD, R.; GUPTA, S.; BAJAJ, A. Cholic-Acid-Derived Amphiphiles Can Prevent and Degrade Fungal Biofilms. ACS Applied Bio Materials, v. 4, n. 9, 2021. https://doi.org/10.1021/acsabm.9b01221
KIM, B.S.; MOON, S.S.; HWANG, B.K. Structure elucidation and antifungal activity of an anthracycline antibiotic, daunomycin, isolated from Actinomadura roseola. Journal of Agricultural and Food Chemistry, v. 48, 1875–1881, 2000. https://doi.org/10.1021/jf990402u
LAGUNIN, A.; STEPANCHIKOVA, A.; FILIMONOV, D.; POROIKOV, V. PASS: Prediction of activity spectra for biologically active substances. Bioinformatics, v. 16, 747–748, 2000. https://doi.org/10.1093/bioinformatics/16.8.747
MALLAVADHANI, U. V.; PANDA, A.K.; RAO, Y.R.; Pharmacology and chemotaxonomy of Diospyros. Phytochemistry, v. 49, 901–951, 1988. https://doi.org/10.1016/S0031-9422(97)01020-0
RAUF, A.; UDDIN, G.; PATEL, S.; KHAN, A.; HALIM, S.A.; BAWAZEER, S.; AHMAD, K.; MUHAMMAD, N.; MUBARAK, M.S. Diospyros, an under-utilized, multi-purpose plant genus: A review. Biomedicine Pharmacotheraphy, v. 91, 714–730, 2017. https://doi.org/10.1016/j.biopha.2017.05.012
SULUB-TUN, R.A.; RODRÍGUEZ-GARCÍA, C.M.; PERAZA-ECHEVERRÍA, L.; TORRES-TAPIA, L.W.; PERAZA-SÁNCHEZ, S.R.; PÉREZ-BRITO, D.; VERA-KU, B.M. Antifungal activity of wild and nursery Diospyros cuneata, a native species of dune scrub. South African Journal of Botany, v. 131, 484–493, 2020. https://doi.org/10.1016/j.sajb.2020.03.029
WANG, X.; HABIB, E.; LEÕN, F.; RADWAN, M.M.; TABANCA, N.; GAO, J.; WEDGE, D.E.; CUTLER, S.J. Antifungal metabolites from the roots of Diospyros virginiana by overpressure layer chromatography. Chemistry and Biodiversity, v. 8, 2331–2340, 2011. https://doi.org/10.1002/cbdv.201000310
















