Autores
Bustos-cortes, J.J. (UNIVERSIDAD NACIONAL DE COLOMBIA - CENIPALMA) ; Chegwin-angarita, C. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Morales-rodríguez, A. (CENIPALMA) ; Aldana-de La Torre, R.C. (CENIPALMA) ; Romero-frías, A.A. (UNIVERSIDAD ANTONIO NARIÑO)
Resumo
En la búsqueda de herramientas para el manejo integrado de Opsiphanes
cassina en el cultivo de palma de aceite, la modificación del comportamiento
en respuesta al uso de estímulos de naturaleza química resulta un escenario
promisorio. Teniendo en cuenta esto, se establecieron las condiciones de
extracción y análisis químico de los VOCs que constituyen la feromona sexual de
la especie. El análisis por CG-EM de las muestras obtenidas por tres
metodologías de extracción (directa con solvente, HS-MEFS y HSD), permitió
detectar VOCs macho-específicos, entre los cuales se encuentra como compuesto
mayoritario el trans-Nerolidol, sesquiterpeno que fue reportado
previamente como componente de la feromona de Opsiphanes invirae, especie
que también es plaga de la palma de aceite.
Palavras chaves
Opsiphanes cassina; Feromona; Control etológico
Introdução
El lepidóptero Opsiphanes cassina Felder, 1862 (Lepidoptera: Nymphalidae:
Satyrinae) es un insecto-plaga que reduce significativamente el rendimiento del
cultivo de palma de aceite en países productores como Colombia, Brasil y Costa
Rica (SIERRA MÁRQUEZ; SIERRA MÁRQUEZ; OLIVERO-VERBEL, 2017)(DAS CHAGAS, 2018)
(MEXZÓN; CHINCHILLA, 2011). El daño en la planta es provocado por el consumo
foliar que realiza el insecto durante el estadio larval. Inicialmente la tasa de
alimentación es baja, afectando solamente los bordes de los folíolos, pero al
llegar al cuarto instar, la larva elige un prospecto y genera una incisión
inclinada en ambos lados de la vena central del folíolo, alcanzando un consumo
de hasta 300 cm3/individuo (MATABANCHOY; RAIGOZA; BUSTILLO, 2018). Esta
condición incide directamente sobre el crecimiento de la palma de aceite ya que,
este depende del desarrollo progresivo de su área foliar; así mismo, la pérdida
de calidad del follaje disminuye la eficacia fotosintética de la planta y, por
tanto, la productividad del cultivo (EDUARDO CAMPEROS REYES et al., 2020)(ALDANA
DE LA TORRE; ALDANA DE LA TORRE, 2011).
Para abordar esta problemática actualmente se realizan prácticas de control
cultural, mecánico, etológico, biológico y químico; sin embargo, no se ha
logrado realizar un manejo integrado de O. cassina que resulte efectivo y
tenga un impacto favorable sobre el ambiente (RODRÍGUEZ et al., 2012). Entre las
estrategias que fomentan los mecanismos naturales de control de adultos de
lepidópteros y generan la menor alteración de los ecosistemas agrícolas, se
encuentra la modificación del comportamiento en respuesta al uso de estímulos de
naturaleza química como las feromonas (GUO et al., 2020). Estas sustancias
corresponden a mezclas de compuestos orgánicos volátiles (VOCs, por sus siglas
en inglés) que median la comunicación intraespecífica de los insectos y son
pieza clave en la localización de parejas, así como en el proceso de cópula
(WYATT, 2017)(SCHULZ, 2004). Además, gracias a su alta especificidad y capacidad
de atracción a bajas concentraciones constituyen una herramienta ideal para el
diseño de trampas cebadas con atrayentes para el monitoreo y reducción de las
poblaciones efectivas de adultos, así como un mecanismo para la interrupción de
la copula (SALAS, 2004)(DOU et al., 2019)(FELIPE BOSA et al., 2008). En el caso
particular de la familia Nymphalidae, subfamilia Satyrinae, se ha reportado que
los machos son los responsables de producir la feromona sexual que regula el
proceso de cópula, encontrando que los VOCs que la componen se derivan tanto de
rutas de biosíntesis endógena reportadas para el orden Lepidoptera, como de
compuestos producidos por la planta hospedera (DAS CHAGAS, 2018)(COTES PRADO et
al., 2018)(“Pherobase :: Family Index - Nymphalidae”, [s.d.])(HEDENSTRÖM et al.,
[s.d.])(WANG et al., 2014)(LIÉNARD et al., 2014)(SCHULZ; STEFFENSKY; ROISIN,
1996)(HAYASHI et al., 1987).
Con estos antecedentes, el objetivo de este trabajo fue establecer las
condiciones de extracción y análisis químico de los compuestos orgánicos
volátiles (VOCs) que constituyen la feromona sexual de la especie bajo estudio.
A partir de la identificación de los VOCs macho-específicos de O.
cassina, en una etapa posterior, se evaluará la respuesta de comportamiento
de los adultos bajo condiciones de laboratorio frente a ellos. Con esto, se
espera tener la base de una propuesta para el monitoreo y manejo de O.
cassina a través del uso de su feromona, en cultivos comerciales de palma de
aceite.
Material e métodos
Insectos
Las pupas se colectaron en cultivos de palma en Puerto Gaitán, Meta-Colombia
durante 2021-2022 y se trasladaron a Bogotá para que emergieran en el
laboratorio. Los adultos se diferenciaron considerando las características de
dimorfismo sexual descritas para especies del mismo género (DAS CHAGAS, 2018).
Los adultos se mantuvieron en jaulas con agua con azúcar como alimento.
Extracción de VOCs
Con el fin de establecer las condiciones bajo las cuales se detectaban VOCs
macho-específicos con cada una de las metodologías de extracción, se realizaron
varios experimentos considerando las características morfológicas, biológicas y
de comportamiento de los insectos, así como la naturaleza química de las
moléculas. Las condiciones que permitieron detectarlos se muestran a
continuación:
Directa con solvente: Los extractos de alas posteriores y abdomen (partes en las
se encuentran las estructuras glandulares en los machos) se obtuvieron de 27
machos y 27 hembras con edad entre 24-72h, durante el horario de cortejo
establecido previamente (18:00-19:00h)(DAS CHAGAS, 2018). Los adultos se
anestesiaron en el congelador 15 min, luego se realizó el desprendimiento de las
secciones glandulares, se sumergieron en hexano y el sobrenadante se filtró con
lana de vidrio(DAS CHAGAS, 2018)(NIEBERDING et al., 2008).
Head-Space Estático con Microextracción en Fase Sólida: Se empleó 1 macho y 1
hembra en presencia de alimento, colocados en recipientes de vidrio (500mL) sin
flujo de aire. La captura de los VOCs se realizó empleando fibras triples de
DVB/CWR/PDMS(Divinilbenceno/Carboxen/Polidimetilsiloxano)(80/10µm). El tiempo de
equilibrio fue de 1h y el tiempo de exposición de 72h. Todas las muestras se
tomaron a temperatura ambiente y usando como blanco una muestra con alimento,
pero sin insectos. La desorción de los compuestos se realizó en el puerto de
inyección a 250°C por 6 minutos(CHOI et al., 2009).
Head-Space Dinámico. Se emplearon 5 machos y 5 hembras en presencia de alimento
y dos foliolos de palma de aceite. Se emplearon recipientes de vidrio de 5 L, en
un sistema cerrado, bajo un flujo continuo de aire húmedo. El tiempo de
extracción fue de 11 días; se usaron HayeSep(DVB) y Porapak(EVB-DVB) como
adsorbentes. Todas las muestras se tomaron a temperatura ambiente y en cada
sistema se realizó una muestra blanco sin insectos. La activación de los
adsorbentes y la desorción de los compuestos se realizó con hexano (YAN et al.,
2018)(DAS CHAGAS, 2018).
Análisis CG-EM
Los extractos obtenidos fueron analizados por cromatografía de gases acoplada a
espectrometría de masas (CG-EM) siguiendo los parámetros analíticos reportados
por (DAS CHAGAS, 2018). Los índices de retención (IR) se calcularon de acuerdo
con el método de Kovats. La asignación tentativa de los compuestos se realizó
por comparación de los EM con los de la librería NIST-17, para la identificación
inequívoca se emplearon patrones.
Resultado e discussão
Estudiar por primera vez la feromona de una especie implica enfrentarse a
muestras de composición desconocida, sin embargo, se puede tener una idea del
tipo de moléculas que la constituyen al considerar la taxonomía del insecto y la
composición química de la planta hospedera. Lo anterior es viable ya que, a
menudo, en individuos de un mismo grupo taxonómico (familia, subfamilia y
género) se presenta la síntesis de moléculas de naturaleza química similar,
indicando la existencia de rutas biosintéticas compartidas (SYMONDS; ELGAR,
2008). Igualmente, debido a la capacidad adaptativa de muchos insectos para
secuestrar componentes de las plantas y emplearlos como precursores o
constituyentes de sus señales químicas (DOMÍNGUEZ et al., 2019). Para obtener
información de la estructura química de los VOCs macho-específicos se realizó el
análisis CG-EM de las muestras de los diferentes tipos de extracción; a
continuación, se presentan los resultados.
En las muestras de extracción directa fue posible detectar 3 VOCs macho-
específicos (Figura 1). Por su parte, en las muestras de HS-MEFS, se detectó 1
VOC macho-específico (Figura 1). El análisis y comparación de los índices de
retención y espectros de masas de los compuestos encontrados por ambas
metodologías de extracción permitió establecer un compuesto mayoritario y común
(1), mientras que los compuestos 2 y 3 sólo se detectaron por extracción
directa.
La identificación tentativa sugiere que los dos VOCs macho-específicos
detectados solo por extracción directa podrían corresponder a hidrocarburos
monoinsaturados de cadena larga (C16-C18), los cuales han sido reportados como
feromonas tipo I para lepidópteros. Este tipo de VOCs se producen por
biosíntesis de ácidos grasos saturados a partir de la Acetil coenzima A, seguida
de modificación de cadena mediante desaturación (FOSTER; ANDERSON, 2018)(TILLMAN
et al., 1999). Los espectros de masas (Figura 2) de estos dos compuestos (IR
1671 y 1675, respectivamente), presentan iones fragmento que coinciden con los
de los compuestos (Z)-7-Hexadeceno y (Z)-7-Heptadeceno. En ambos casos se
presentan picos separados por 14 unidades de masa que representan la pérdida de
(CH2)n (por ejemplo, m/z 97 → m/z 83 → m/z 69 → m/z 55), característicos de
cadenas de hidrocarburos monoinsaturados con más de 15 unidades de carbono. Para
confirmar la identidad de estos compuestos se requiere realizar el análisis y
comparación con patrones. El (Z)-7-Hexadeceno y (Z)-7-Heptadeceno sugeridos, han
sido reportados como VOCs macho-específicos de O. invirae, especie que también
es insecto-plaga de la palma de aceite. No obstante, en la evaluación por
electroantenografía, solo el (Z)-7-Heptadeceno mostró una respuesta positiva
para las antenas de las hembras, indicando que el (Z)-7-Hexadeceno no está
involucrado en la comunicación sexual de la especie (DAS CHAGAS, 2018).
Por otro lado, el análisis del VOC mayoritario (IR 1563), sugirió al trans-
Nerolidol como posible candidato. En el espectro por IE a 70 eV (Figura 2), se
alcanza a observar el pico de ion molecular [M]+ en m/z 222 que coincide con el
peso molecular de este sesquiterpeno. La señal en m/z 204 concuerda con el
fragmento [M − HOH]+, que indica la pérdida de agua por eliminación de un
hidrógeno en posición 4. En m/z 69 se observa un pico base característico de la
fragmentación de terpenos, que corresponde el grupo isoprenil [CH2CHC(CH3)2.].
Este sesquiterpeno ha sido reportado principalmente como metabolito secundario
de plantas, sin embargo, también se encontró como constituyente de la feromona
sexual de O. invirae (DAS CHAGAS, 2018). considerando sus características
estructurales y las rutas de biosíntesis del orden taxonómico, este VOC debería
ser obtenido directamente de la planta hospedera o producido a partir de un
precursor presente en ella.
Existen importantes discusiones en torno a la posibilidad de que los insectos
pueden usar compuestos obtenidos directamente de la planta huésped como fuente
de feromonas. Esto se debe a que la dieta es posiblemente el factor ambiental
más importante que influye en las señales químicas en los insectos. En casos muy
particulares, los componentes de la dieta se convierten directamente en
feromonas, pero de manera más general, la variación en la dieta de un individuo
influye en su desarrollo y, por lo tanto, en su capacidad para sintetizar la
señal (MCNEIL; DELISLE, 1989).
Los resultados del análisis CG-EM de la extracción por HSD, realizado en
presencia de la planta hospedera, mostraron 1 VOC que estaba presente solamente
en muestras de machos (ausente tanto en muestras de hembra como de la planta)
(Figura 1). El índice de retención y los iones fragmento para este compuesto,
mostraron que también podría corresponder al trans-Nerolidol.
Para confirmar sí el VOC macho-específico mayoritario, que se detectó con las
tres metodologías, correspondía al sesquiterpeno propuesto, se realizó el
análisis CG-EM de un patrón bajo las mismas condiciones analíticas, encontrando
que en efecto correspondía al trans-Nerolidol (Figura 2). El isómero trans
presenta dos estereoisómeros, para determinar cuál de ellos (o sí ambos), es
liberado por los machos de esta especie debe realizarse posteriormente un
análisis con una columna quiral (TABACCHI et al., 2010).
El Nerolidol es un sesquiterpeno presente en el aceite esencial de la parte
aérea de muchas plantas aromáticas y presenta una amplia gama de actividades
biológicas (CHAN et al., 2016). El isómero trans se ha identificado como
cairomona en cuatro plantas hospederas (Lycopersicon esculentum, Capiscum
annuum, Datura wrightii, Proboscidea parviflora) de la especie Manduca sexta
(Lepidoptera: Sphingidae)(FRASER; MECHABER; HILDEBRAND, 2003). Por su parte, el
isómero cis ha sido identificado como cairomona de plantas de arroz (Oryza
sativa), actuando como atrayente de dos especies simpátricas que atacan el
cultivo Cnaphalocrocis medinalis y Marasmia patnalis (Lepidoptera: Pyralidae)
(RAMACHANDRAN et al., 1990). En cuanto a reportes como feromona de lepidópteros,
solo se encuentra el estudio de la especie O. invirae, que también es insecto-
plaga de la palma de aceite. En ese trabajo se encontró que el trans-Nerolidol
es uno de los VOCs que constituye la feromona sexual de la especie ya que en los
ensayos electroantenográficos soló genero respuesta en las hembras;
adicionalmente en las pruebas en campo generó una captura eficiente de adultos
(machos y hembras) en combinación con cebos alimenticios (DAS CHAGAS, 2018).
Respecto a cómo el insecto produce este compuesto, al considerar las rutas
biosintéticas que se han reportado para los lepidópteros no es posible proponer
la síntesis endógena total del Nerolidol por parte de O. invirae u O. cassina,
sino que, en su lugar, estos deben tomar de la planta hospedera el compuesto o
un precursor (WANG et al., 2014)(LIÉNARD et al., 2014)(SCHULZ; STEFFENSKY;
ROISIN, 1996)(HAYASHI et al., 1987).
Al revisar los reportes sobre los VOCs presentes en hojas de especies de palmas
(familia Aracaceae), se encuentran monoterpenos como α- y β-Pineno, 3-Careno,
Limoneno, Linalool, β-Ocimeno y Terpinoleno, al igual que los sesquiterpenos α-
farneseno y farnesol (AGOSTINI-COSTA, 2018). Teniendo en cuenta que lo anterior,
es posible sugerir que los insectos durante el estadio larval toman y almacenan
algunos de estos compuestos y posteriormente los adultos los usan como
precursores para la producción de uno de los VOCs de su feromona (BLAUL et al.,
2014).
Aún cuando exista una fuerte influencia de la planta hospedera, la composición
de la mezcla de la feromona es especie-específica, lo que la convierte en una
estrategia para el aislamiento reproductivo y la especiación. Por esto, la
identificación de las estructuras químicas y la composición de las mezclas que
constituyen las feromonas se considera la base para comprender la comunicación
química y su papel en la evolución de la ecología (NOJIMA et al., 2018).
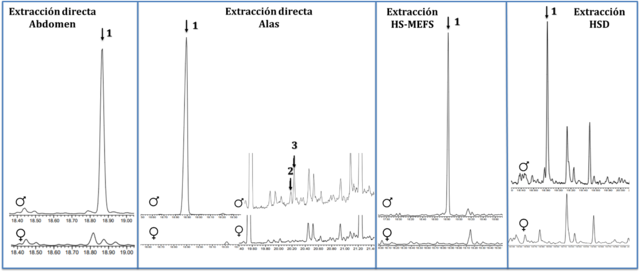
Cromatogramas de VOCs detectados por diferentes metodologías de extracción (Columna HP-5). Las flechas señalan VOCs macho-específicos.
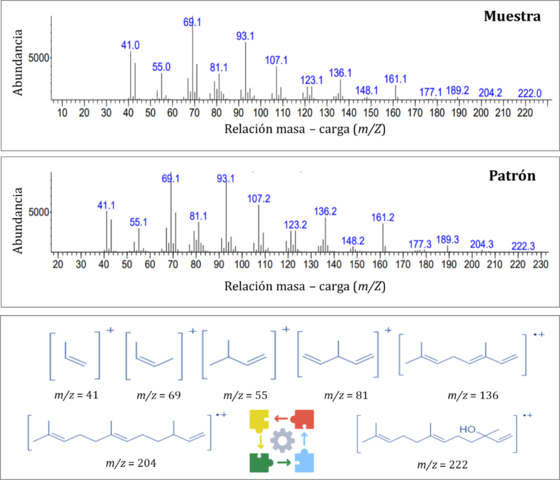
Comparación de espectros de masas (IE a 70 eV) del trans-Nerolidol en muestras respecto al patrón de referencia.
Conclusões
Los resultados de este trabajo indican que la comunicación de la especie O.
cassina es mediada por semioquímicos, más específicamente por VOCs liberados por
los machos que sugieren ser los componentes de su feromona sexual. El VOC
mayoritario se logró extraer a través de las tres metodologías evaluadas y se
identificó como uno de los estereoisómeros del trans-Nerolidol. Este compuesto ha
sido reportado como uno de los constituyentes de la feromona sexual producida por
machos de O. invirae, especie que también es plaga de la palma de aceite. A partir
de la identificación de los VOCs macho-específicos se espera en una etapa
posterior contribuir al desarrollo de la feromona para incluirla dentro de la
estrategia para el monitoreo y manejo de O. cassina en cultivos comerciales de
palma de aceite.
Agradecimentos
Los autores ofrecen sus agradecimientos a Cenipalma, a la Universidad Nacional de
Colombia y a la Universidad Antonio Nariño por su apoyo en la realización de este
proyecto.
Referências
AGOSTINI-COSTA, T. DA S. Bioactive compounds and health benefits of some palm species traditionally used in Africa and the Americas – A review. Journal of Ethnopharmacology, v. 224, p. 202–229, 5 out. 2018.
ALDANA DE LA TORRE, R. C.; ALDANA DE LA TORRE, J. A. Reconocimiento y manejo de insectos defoliadores y asociados a la pestalotiopsis. [s.l.] Centro de Investigación en Palma de Aceite, Cenipalma, 2011.
BLAUL, B. et al. Oleic acid is a precursor of linoleic acid and the male sex pheromone in Nasonia vitripennis. Insect Biochemistry and Molecular Biology, v. 51, n. 1, p. 33–40, 1 ago. 2014.
CHAN, W. K. et al. Nerolidol: A sesquiterpene alcohol with multi-faceted pharmacological and biological activities. Molecules, v. 21, n. 5, p. 529, 28 abr. 2016.
CHOI, K. S. et al. Sex pheromone composition of the cotton caterpillar, Palpita indica (Lepidoptera: Pyralidae), in Korea. Journal of Asia-Pacific Entomology, v. 12, n. 4, p. 269–275, 1 dez. 2009.
COTES PRADO, A. M. et al. Control biológico de fitopatógenos, insectos y ácaros: Agentes de control biológico (Volumen 1 y 2). 1. ed. [s.l.] Corporación Colombiana de Investigación Agropecuaria (Agrosavia), 2018.
DAS CHAGAS, K. ESTUDO DO FEROMÔNIO DE OPSIPHANES INVIRAE (HUBNER, 1818) (LEPIDOPTERA: NYMPHALIDAE). [s.l.] Universidade Federal de Alagoas, Programa de Pós-Graduação da Rede Nordeste de Biotecnologia- Renorbio, 2018.
DOMÍNGUEZ, A. et al. Influence of Age, Host Plant and Mating Status in Pheromone Production and New Insights on Perception Plasticity in Tuta Absoluta. Insects 2019, Vol. 10, Page 256, v. 10, n. 8, p. 256, 20 ago. 2019.
DOU, X. et al. Pheromone gland transcriptome of the pink bollworm moth, Pectinophora gossypiella: Comparison between a laboratory and field population. PLoS ONE, v. 14, n. 7, p. e0220187, 22 jul. 2019.
EDUARDO CAMPEROS REYES, J. et al. Propuesta metodológica para estimar la defoliación en la palma de aceite. [s.l: s.n.].
FELIPE BOSA, O. et al. Control of Tecia solanivora (Lepidoptera: Gelechiidae) through its pheromone for mating disruption. Revista Colombiana de Entomología, v. 34, n. 1, p. 68–75, 2008.
FOSTER, S. P.; ANDERSON, K. G. Differential Pheromone Sampling of the Gland of Female Heliothis Virescens Moths Reveals Glandular Differences in Composition and Quantity. Journal of Chemical Ecology, v. 44, n. 5, p. 452–462, 1 maio 2018.
FRASER, A. M.; MECHABER, W. L.; HILDEBRAND, J. G. Electroantennographic and Behavioral Responses of the Sphinx Moth Manduca sexta to Host Plant Headspace Volatiles. Journal of Chemical Ecology 2003 29:8, v. 29, n. 8, p. 1813–1833, 1 ago. 2003.
GUO, J. M. et al. Functional characterization of sex pheromone receptors in the fall armyworm (Spodoptera frugiperda). Insects, v. 11, n. 3, 2020.
HAYASHI, N. et al. γ-Decalactone, an Odoriferous Compound from the Male Butterfly, Lethe marginalis Motschulsky. Zeitschrift für Naturforschung C, v. 42, n. 7–8, p. 1001–1002, 1 ago. 1987.
HEDENSTRÖM, E. et al. Stereoisomeric Analysis of 6,10,14-Trimethylpentadecan-2-ol and the Corresponding Ketone in Wing Extracts from African Bicyclus Butterfly Species. [s.d.].
LIÉNARD, M. A. et al. Sex pheromone biosynthetic pathways are conserved between moths and the butterfly Bicyclus anynana. Nature Communications, v. 5, 2014.
MATABANCHOY, J. A.; RAIGOZA, D.; BUSTILLO, A. E. (PDF) Biología de Opsiphanes cassina defoliador palma de aceite en Colombia. [s.l: s.n.]. Disponível em: <https://www.researchgate.net/publication/340794229_Biologia_de_Opsiphanes_cassina_defoliador_palma_de_aceite_en_Colombia>. Acesso em: 14 mar. 2021.
MCNEIL, J. N.; DELISLE, J. Are host plants important in pheromone-mediated mating systems of lepidoptera? ExperientiaBirkhäuser-Verlag, , mar. 1989.
MEXZÓN, R. G.; CHINCHILLA, C. M. Opsiphanes cassina Felder (Lepidoptera: Nymphalidae), defoliator of the oil palm (Elaeis guineensis Jacquin) in Central America. ASD Oil Palm Papers, v. 36, p. 14–33, 2011.
NIEBERDING, C. M. et al. The male sex pheromone of the butterfly Bicyclus anynana: Towards an evolutionary analysis. PLoS ONE, v. 3, n. 7, p. e2751, 23 jul. 2008.
NOJIMA, S. et al. Qualitative and quantitative analysis of chemicals emitted from the pheromone gland of individual Heliothis subflexa females. PLoS ONE, v. 13, n. 8, 1 ago. 2018.
Pherobase :: Family Index - Nymphalidae. Disponível em: <https://www.pherobase.com/database/family/family-Nymphalidae.php>. Acesso em: 25 out. 2021.
RAMACHANDRAN, R. et al. Olfactory sensitivity of two sympatric species of rice leaf folders (Lepidoptera: Pyralidae) to plant volatiles. Journal of Chemical Ecology 1990 16:9, v. 16, n. 9, p. 2647–2666, set. 1990.
RODRÍGUEZ, G. et al. Tecnología agronómica de la palma aceitera (Elaeis guineensis Jacq,) y manejo integrado de su defoliador Opsiphanes cassina Felder (Lepidoptera: Brassolidae) en plantaciones comerciales del estado Monagas, Venezuela. Revista Científica UDO Agrícola, v. 3, p. 584–598, 2012.
SALAS, J. Captura de Tuta absoluta (lepidoptera: Gelechiidae) en trampas cebadas con su feromona sexual. Revista Colombiana de Entomologia, v. 30, n. 1, 2004.
SCHULZ, S. The Chemistry of Pheromones and Other Semiochemicals I. [s.l: s.n.]. v. 239
SCHULZ, S.; STEFFENSKY, M.; ROISIN, Y. Identification and synthesis of elymniafuran, a new monoterpene from the butterfly elymnias thryallis. Liebigs Annales, v. 94, n. 6, p. 941–946, 1996.
SIERRA MÁRQUEZ, J.; SIERRA MÁRQUEZ, L.; OLIVERO-VERBEL, J. Potencial económico de la palma aceitera (Elaeis guineensis Jacq). Agronomía Mesoamericana, v. 28, n. 2, p. 523, 30 abr. 2017.
SYMONDS, M. R. E.; ELGAR, M. A. The evolution of pheromone diversity. Trends in Ecology and Evolution, abr. 2008.
TABACCHI, R. et al. A guide to the analysis of chiral compounds by GC. Restek Cor, p. 1–23, 2010.
TILLMAN, J. A. et al. Insect pheromones - An overview of biosynthesis and endocrine regulation. Insect Biochemistry and Molecular Biology, v. 29, n. 6, p. 481–514, 1 jun. 1999.
WANG, H.-L. et al. Identification and Biosynthesis of Novel Male Specific Esters in the Wings of the Tropical Butterfly, Bicyclus martius sanaos. Journal of Chemical Ecology 2014 40:6, v. 40, n. 6, p. 549–559, 4 jun. 2014.
WYATT, T. D. Pheromones. Current BiologyCell Press, , 7 ago. 2017.
YAN, Q. et al. Chemical analysis of the female sex pheromone in Palpita nigropunctalis (Lepidoptera: Crambidae). Journal of Asia-Pacific Entomology, v. 21, n. 4, p. 1283–1288, 1 dez. 2018.
















