Autores
de Oliveira Ferreira, L. (IFRJ) ; Mara dos Santos Oliveira, I. (UFRJ) ; Nunes Melo dos Santos, L. (UFRJ) ; da Silva Honorio, T. (UFRJ) ; Gil Melgaço, F. (IFRJ) ; Jaeger de Carvalho, L.M. (UFRJ) ; Mendes Cabral, L. (UFRJ) ; Coli Louvisse de Abreu, L. (IFRJ)
Resumo
A atividade cicatrizante de plantas medicinais vem sendo estudada e tem se
mostrado promissora, revelando que a reparação tecidual é devido ao efeito
sinérgico dos metabólicos secundários presentes. Até o presente momento não foi
encontrado nenhum estudo avaliando a atividade de cicatrização de feridas
utilizando a polpa de juçaí. Sendo assim o objetivo desse trabalho é demonstrar
a atividade cicatrizante da polpa de jucai. Foi avaliado a composição
cromatográfica, o efeito citotóxico e a migração celular. Sendo verificado que a
quantidade de antocianinas totais esta de acordo com o preconizado com a
literatura. As diferentes concentrações testadas não foram citotóxicas às
células testadas e foi possível observar que o extrato foi capaz de promover a
migração celular em 48h.
Palavras chaves
jucai; cicatrização de feridas; migração celular
Introdução
A pele é o principal órgão de proteção do corpo humano. Uma vez lesionada ou
ferida o organismo tende a ficar vulnerável a entrada de microorganismos
patógenos (ALMEIDA, 2009; VEIGA, 2009). A capacidade da pele de agir como uma
barreira é determinada principalmente por células que mantêm a continuidade e
integridade da pele e a restauram após feridas (MARTINS et al, 2006). A
cicatrização de feridas cutâneas não é um processo simples no qual são
sintetizados fatores de crescimento que ativam a proliferação e migração
celular. Em vez disso, a cicatrização de feridas é um processo complexo de
várias etapas que envolve eventos dérmicos e epidérmicos (CLARK, 1997).
Uma substância pode ser utilizada no processo de cicatrização é o Juçaí. O
Brasil é depositário de enorme flora riquíssima em matéria prima que tem
despertado o interesse de pesquisadores de várias universidades e instituições
dedicadas a fitoterapia. A região de mata atlântica e amazônica é considerada
fonte inesgotável de potencialidades terapêuticas com o uso de plantas
medicinais (MARTINS et al., 2006).
A juçara (Euterpe edulis Martius), pertence à família Arecaceae, sendo do gênero
Euterpe, é popularmente conhecida como palmiteiro, juçara, içara, ripa, juçaí,
entre outros (Nodari et al, 2000).
A polpa de juçaí apresenta composição bioativa semelhante à do açaí. Entretanto
tem apresentado mais antioxidante, devido a maior quantidade de antocianinas
presente no fruto. Apresenta uma elevada capacidade antioxidante e citoprotetor
em termos de danos oxidativos (ALABARCE, 2016).
O açaí, fruto semelhante ao juçaí, apresenta atividade antibacteriana e
cicatrizante, o que torna possível que o juçaí apresente as mesmas atividades
(JESUS, 2012).
Material e métodos
Obtenção e caracterização das Polpas de Juçaí
Teor de antocianinas e antocianidinas foi realizado por cromatografia líquida de
alta eficiência (CLAE),
Ensaio de Citotoxicidade Cultura celular
Células HaCaT (queratinócitos humanos imortalizados), apresentando plena
diferenciação epidérmica, foram cultivadas em meio DMEM suplementado com 10% de
soro fetal bovino (SFB), 4 mM de L-glutamina, antibióticos (100 U/mL de
penicilina e 100 μg/mL de estreptomicina) à 37° C e 5% de atmosfera de CO2 sob
constante umidificação.
Ensaio de viabilidade celular por MTT
Para a avaliação do efeito citotóxico de diferentes concentrações das amostras
diante das células HaCaT foi utilizado o ensaio de MTT. Em placa de 96 poços,
5x105 células/ poço foram incubadas à temperatura de 37°C e 5% de CO2 durante 24
horas. As células foram expostas às amostras em diversas diluições em meio de
cultura por 24 horas. Em seguida, as amostras foram removidas e as células
tratadas com reagente de MTT. As leituras de absorbância dos poços foram
realizadas em leitor de microplaca a 570 nm (Silva et al., 2018).
Ensaio de migração celular (cicatrização)
As células foram plaqueadas em placas de 24 poços contendo 1 x 105 células/poço.
Após 24 horas, atingindo a confluência, as monocamadas foram riscadas
manualmente com auxílio de ponteira de pipeta de 200 μL para geração de uma
“ferida”. As células foram incubadas por 24 horas em meio de cultura contendo
0,5% de SFB, assim como as diluições de formulações/insumos com potencial
cicatrizante. As “feridas” foram observadas em microscópio invertido com
contraste de fase e as suas áreas foram medidas através do software ImageJ em
diferentes tempos (Fernandes et al, 2021)
Resultado e discussão
Uma nova metodologia analitica foi desenvolida a fim de avaliar as antocianinas
presentes na polpa do juçai. O método proposto foi mais simples e rápido que os
métodos disponiveis na literatura atual. Para tal foi utilizada a eluição
isocrática com fase móvel contendo 16% de Metanol acidificado com acido fórmico
e 84% de 10% de acido formico em água. o tempo de retenção avaliado foi de 7,4
min para o glicosideo e 10,7 minutos para o rutenosideo. e o teor encontrado foi
de 552mg/100g para o glicosideo e 4056mg/100g de polpa para o rutenosideo.
As diferentes concentrações testadas (0,01 a 5% de polpa de jucai) não foram
citotóxicas as células testadas já as concentrações maiores (7,5 e 10%)
apresentaram viabilidade celular inferior a 70%, conforme demonstrado na figura
1, ou seja, as concentrações menores (até 5%) demonstraram ser seguras aos
queratinócitos humanos.
Foi possível observar que o extrato a 1% foi capaz de promover a migração
celular (fechar a ferida) em 48h conforme a figura 2, diferente do controle que
não fechou completamente a ferida. Sendo assim pode-se
inferir que o juçai é um potencial para o uso em cicatrização de feridas.
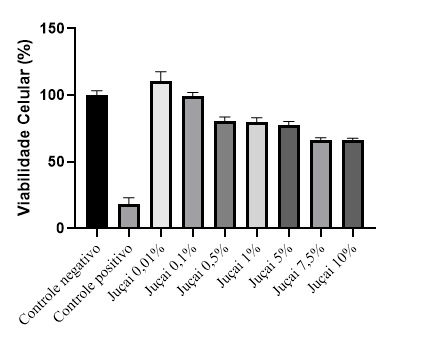
Viabilidade celular (%) de celulas HaCat: controle negativo (DMEM 10%), controle positivo (DMSO), amostras em diferentes concentrações, n=8
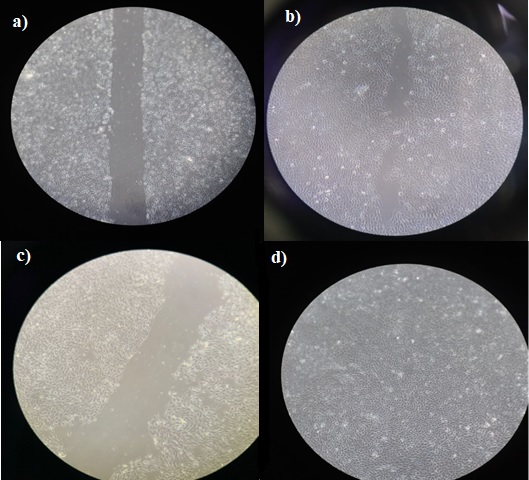
Migração celular a) DMEM tempo zero b)DMEM 48h c) Juçai 1% tempo zero d) juçai 1% 48h
Conclusões
Foi possivel desenvolver uma metodologia analitica mais rapida e tão eficaz quanto
as metodologias disponiveis na litaratura, com um tempo de corrida de apenas 12
minutos.
foi possivel avaliar a segurança do jucai frente as celulas de queratinócitos
humanos e avaliar a sua capacidade de promover a migração celular, conduzindo a
uma concluir que o jucai apresenta atividade cicatrizante in vitro. Logo objetiva-
se desenvolver formulações contendo juçai visando o tratamento de feridas.
Agradecimentos
A FAPERJ, CNPq e ao IFRJ pelo auxilio financeiro.
A UFRJ por ceder a sua estrutura para os testes in vitro.
Referências
Almeida, T.L. “Desenvolvimento de membrana composta de PVAI e quitosana compatível com o sistema dermo-epidérmico”, Dissertação de Mestrado, IPEN/USP, São Paulo 2009.
Clark, R.A.F.,Wound repair. Lessons for tissue engineering, in: R.P. Lanza, R. Langer, W. Chick(Eds.), Principles of Tissue Engineering, Academic Press, San Diego 1997.
Fernandes, D.M.; Barbosa, W.S. Melgaço, F.G.; Dias, M.L.; Ricci-Junior, E.; Abreu, L.C.L.; Monteiro, M.S.B. Polymeric membrane based on polyactic acid and babassu oil for wound healing; Materials Today Communications v. 26, 102173, 2021.
Jesus, A.C.S. DESENVOLVIMENTO DE POMADA À BASE DO EXTRATO DE AÇAÍ (EUTERPE OLERACEA) E SEU EFEITO CICATRIZANTE, trabalho de conclusão de curso –UEZO, 2012
Martins NLP, Malafaia O, Ribas-Filha JM, Heibel M, Baldez RN, Vasconcelos PRL, Moreira H, Mazza M, Nassif PAN. Análise comparativa da cicatrização da pele com o uso intraperitoneal de extrato aquoso de Orbignya phalerata (babaçu). Estudo
controlado em ratos. Acta Cir Bras. 2006;21 Supl 3:66-75.
Nodari, R.O.; Reis, M.S.; Guerra, M.P. (2000) Conservação do palmeiteiro (Euterpe edulis Martius). In: Euterpe edulis Martius (palmeiteiro): biologia, conservação e manejo. Reis, M.S.; Reis. A. (Eds.). Itajaí, Herbário Barbosa Rodrigues.
Veiga, I.G, “Uso de xantana em substituição ao alginato em membranas coacervadas de quitosana projetadas para a cicatrização de lesões de pele”, Dissertação de Mestrado, Faculdade de Engenharia Química, Universidade Estadual de Campinas, Campinas, 2009.
















