Autores
Almeida, C.E.S. (UEPA) ; Lima, M.M. (UFPA / IFPA) ; Cruz, W.P. (UNIFESSPA / IFPA) ; Franco, A.R.B. (UFPA / IFPA) ; Nascimento, W.L. (UEPA) ; Collinge, M.D.R. (UFPA / IFPA) ; Silva, V.L.D. (UFPA / IFPA) ; Coutinho, R.M.P. (UFV / IFPA)
Resumo
Macroptilium lathyroides (L.) Urb. é uma leguminosa e possue poucos estudos a
respeito de sua composição química. O objetivo do presente estudo foi quantificar
os conteúdos de fenólicos e antocianinas totais pelo método colorimétrico Folin-
Ciocalteau e identificar os compostos fenólicos através de Cromatografia Líquida
de Alta Eficiência (HPLC-MS). Os prováveis fenólicos identificados nesse estudo
foram Ácido clorogênico, Ácido p-hidroxibenzóico, Vitexina/Isovitexina,
Resveratrol, Quercetina e Orientina. Diante destes resultados, essa flor pode ser
considerada uma fonte natural saudável, rica em antioxidantes e pigmentos, podendo
colorir naturalmente suas refeições.
Palavras chaves
Macroptilium lathyroides;; Compostos fenólicos;; antocianinas.
Introdução
A Química dos Produtos Naturais sofreu avanços consideráveis na química orgânica
que possibilitou o isolamento e caracterização de substâncias produzidas pelo
metabolismo secundário de plantas. Através desse ramo da química é possível
perquirir compostos de interesse, de pesquisadores e indústrias, a fim de se
conhecer a composição química das plantas, e assim exceler a capacidade bioativa
de muitas substâncias naturais (Berlinck, Borges, Scotti & Vieira, 2017).
De acordo com Silva, Carneiro, Edvan e Santiago (2017), Macroptilium lathyroides
(L.) Urb. é uma espécie que apresenta limitações de crescimento e
desenvolvimento quando expostas ao solo com característica hidromórfica, todavia
vegeta em locais mal drenado e com pH baixo. Essa espécie é uma leguminosa que
apresenta caules eretos e suas flores com coloração vermelho-violáceas ou azul-
violáceas.
As flores comestíveis agregam um aroma fresco e exótico, sabor delicado e um
apelo visual que as torna cada vez mais utilizadas na culinária gourmet. Dahlia
mignon, Rosa damascena 'Alexandria', Calendula officinalis L. e Centaurea
cyanus L. estão entre as flores comestíveis mais populares (Fernandes, Casal,
Pereira, Saraiva e Ramalhosa, 2017). A M. lathyroides é uma das espécies em que
se apresenta poucos relatos a respeito de sua composição química, porém, sabe-se
que a mesma é rica em flavonoides, alcaloides, terpenóides e esteroides (Sousa
et al. 2017;).
Os flavonoides são uma classe de polifenóis, sendo subdividido em: flavonas,
flavanonas, isoflavonas, flavanóis e antocianinas. Os compostos fenólicos são
produzidos por meio do metabolismo secundário de plantas e exercem diversas
funções, dentre elas como contribuinte na pigmentação de vegetais (Rossa et al.
2017). Segundo Santos, Sena, Costa, Santos e Santos (2018), os compostos
fenólicos são conhecidos pelas suas propriedades antioxidantes naturais,
presentes nas antocianinas, e várias outras atividades biológicas.
As antocianinas são compostos fenólicos responsáveis por pigmentações de flores,
frutas, folhas, caules e raízes de plantas da família dos flavonoides. Os
compostos fenólicos compreendem substâncias que apresentam anel aromático com um
ou mais substituintes hidroxílicos, incluindo seus grupos funcionais (Rossa et
al. 2017; Condori, Aro, Cáceres e Mendoza, 2020).
As antocianinas, além de pigmentos, desempenham atividade antioxidante onde
apresentam-se em diferentes estruturas em equilíbrio. São componentes químicos
que dependem do pH da solução, da temperatura, luminosidade, dentre outros
fatores determinantes. Trata-se, portanto, de um composto químico que apresenta
alguns padrões de estabilidade, tornando difícil identificar um único fator que
explique suas mudanças de coloração e propriedades funcionais (De Paula,
Heemann, Heemann e De Lima, 2019).
Pesquisadores relatam diversas propriedades funcionais atribuídas às
antocianinas, como a redução de estresse oxidativo, potencial antividade
anticarcinogênica, cardiovasculares, diabetes, entre outros (Flores-Aguilar,
Flores-Rivera, Del, 2018; Hurtado e Charfuelan, 2019).
Chefs de todo o mundo se esforçam para ir além do comum no preparo de novas
receitas, enfeitando seus pratos com flores ou usando-os como ingredientes em
saladas, sopas, entradas, sobremesas e bebidas (Pires et al. 2018). Este
presente trabalho teve por objetivo quantificar os fenólicos e antocianinas
totais e identificar compostos fenólicos presentes em extrato fitoquímico de
flores de Macroptilium lathyroides (L.) Urb. visto que essa espécie é rica em
flavonoides e outros componentes, mas inópia de relatos na literatura quanto a
esses compostos, apontando essa flor como uma possível alternativa potencial
comestível.
Material e métodos
O material botânico foi coletado em uma via principal do Núcleo Nova Marabá,
cidade de Marabá, estado do Pará. O material foi separado manualmente visando se
obter as flores, com a eliminação dos caules. As flores foram submetidas a
imersão em água destilada. O processo de extração do pigmento antociânico foi
realizado de acordo com a metodologia adaptada de Fuleki e Francis (1968).
Primeiramente, as flores foram pesadas e, posteriormente, foram submergidas em
água destilada. Na sequência, as flores foram transferidas para um almofariz
para se realizar a maceração do material com o auxílio de um pistilo em
porcelana. Devidamente pesadas e trituradas 36g das pétalas de flores, foi
adicionado 165 ml de solvente extrator na proporção 70:30 (Etanol-Água). Em
seguida, foi adicionado solução de HCl 0,1M até que o meio fosse ajustado para
pH=2. O material foi transferido para frasco âmbar e deixado em repouso durante
72 horas em refrigerador a 5ºC, ao abrigo da luz para evitar a degradação ou
oxidação dos compostos químicos. Após esse período, foi realizado uma filtração
simples do material em ambiente com baixa luminosidade e novamente armazenado em
outro frasco âmbar. A fim de se obter um extrato concentrado, toda a amostra foi
submetida a evaporador rotativo à vácuo com temperatura igual a 40ºC. O balão de
fundo redondo com junta esmerilhada foi envolto com papel alumínio para que o
material contido não tivesse contato constante com a luminosidade.
A determinação dos compostos fenólicos foi realizada pelo método colorimétrico
Folin- Ciocalteau. As alíquotas do extrato aquoso foram diluídas com álcool
etílico 70%, onde 1 ml de extrato aquoso foi diluído em balão volumétrico, na
ausência de luz, até que se atingisse 25ml de solução final. Em um tubo de
ensaio foi adicionado 600 μL da amostra diluída e em seguida adicionada 3000 μL
do reativo de Folin-Ciocalteau 2N. Após adição do reagente, foi realizado a
homogeneização da mistura em agitador vortex, onde posteriormente foi deixado em
repouso por 3 minutos. Após esse período, foi acrescentado ao tubo de ensaio
2400 μL de carbonato de sódio (Na2CO3) a 7,5% e homogeneizado novamente em
agitador vortex. A seguir, a mistura foi deixada em repouso por 1 hora. Após
esse período de incubação à temperatura ambiente, a absorbância foi mensurada em
espectrofotômetro UV-vis Cary 60-Agilent Technologies a um comprimento de onda
de 760 nm, usando a água destilada como branco. Para a realização da curva
padrão (Figura 1), utilizou-se o ácido gálico nas concentrações de 50, 100, 150,
200, 250, 350, 400, 450 e 500 mg.mL–1 dissolvido em água destilada. A partir da
reta obtida, realizou-se o cálculo do teor de fenólicos totais, expressos em
equivalentes de ácido gálico (mg de ácido gálico.100 g–1 da amostra úmida).
Resultado e discussão
Os compostos bioativos nas flores, como noutros vegetais, são metabolitos
secundários da planta, e incluem, por exemplo, carotenoides e compostos
fenólicos (dentro destes encontram-se os flavonoides e as antocianinas), os
quais estão associados a benefícios para a saúde humana. Esses compostos têm
sido a base de muitos estudos em flores comestíveis, verificando-se que os seus
teores variam entre espécies e de acordo com outros fatores, incluindo o período
de floração, solo e clima (Fernandes, Casal, Pereira, Saraiva e Ramalhosa,
2016).
Observou-se que os resultados obtidos para os teores de polifenóis totais
(284,51 mgGAE/100g), antocianinas totais (1131,97 mg/100g) e capacidade
antioxidante (14,88 μmol de Trolox/g presents na Macroptilium lathyroides (L.)
Urb. vermelho-violáceas, foram significativos, sendo superiores a alguns
trabalhos da literatura (Tabela 1).
O teor de antocianina pode ser determinado por vários métodos, por esse motivo
as concentrações podem ser variáveis. Além disso, esses teores podem ser
influenciados de acordo com as condições em que o material exposto, como o
clima, a temperatura, iluminação, cultivo (Luciana, Stringheta, Oliveira, 2008).
Os compostos fenólicos totais, em flores comestíveis, são muito variáveis. No
estudo de Gonçalves, Silva e Carlos (2019), com flores comestíveis, o conteúdo
de fenólicos totais, variou de 0,14 a 3,2 g EAG/100g, sendo maior nas flores de
capuchinha-laranja e de amor-perfeito com médias de 3,2 e 2,9 g EAG/100g,
respectivamente. Os valores de antocianinas totais encontrados em algumas flores
comestíveis variaram entre 2,8 mg/100 g a 58,9 mg/100, sendo que os maiores
teores foram das flores capuchinha-laranja e amor-perfeito com teores de 58,9 e
45,1 mg/100g, respectivamente.
Para Da Silva, Wiest e Carvalho (2016) o teor de compostos fenólicos no hibisco
vermelho e branco foi de 155,85 ± 0,95 e 84,68 mg EAG/100g, respectivamente. Já
a dosagem de antocianinas encontrada na amostra foi de 85,71 e 10,87 mg/100g,
respectivamente, demonstrando assim que os teores encontrados nas flores
estudadas são relevantes.
Quanto à atividade antioxidante de flores, de acordo com Souza, Nascimento,
Stringheta, Barros (2020), os dados referentes ao ensaio das flores de
capuchinha vermelha (Tropaeolum majus L.) apresentaram capacidade antioxidante
que variaram de 13,59 μmol de Trolox/g seguido pelas flores alaranjadas 4,10
μmol de Trolox/g e amarelas 2,99 μmol de Trolox/g, através do método ABTS.
Para Souza et al. (2020), as flores vermelhas apresentaram a maior capacidade
antioxidante por conterem a maior concentração de compostos fenólicos o que
poderiam ser mais utilizadas na alimentação humana devido aos seus potenciais
benefícios para a saúde.
Os resultados obtidos pela análise de CLAE do extrato fitoquímico (Figura 3)
indicam presença de vários compostos fenólicos.
Esses compostos foram relacionados para a prevenção de doenças crônico-
degenerativas, como diabetes, declínio cognitivo e doenças cardiovasculares, bem
como diferentes tipos de câncer através da inibição de sua iniciação e
progressão pela modulação de genes envolvidos em processos de regulação chave
(Pires et al. 2018).
Figura 3. Cromatograma de HPLC – MS/MS do extrato da flor de Macroptilium
lathyroides (L.) Urb. Os compostos orgânicos presentes no cromatograma são de
autoria de Rossa et al. (2017).
Portanto, o consumo de diversos tipos de flores comestíveis traz
benefícios à saúde do consumidor, pois são uma boa fonte de fitoquímicos,
incluindo compostos fenólicos (Fernandes et al., 2017). Os principais compostos
químicos presentes no extrato da flor de M. lathyroides (Tabela 2), são
conhecidos na literatura por apresentarem ação antioxidantes. A análise revelou
alguns compostos também presentes no açaí e na uva (Da Silva e Rogez, 2013;
Gordon et al. 2012; Di Lecce, Jáuregui, Tresserra-Rimbau, Quifer-Rada e Lamuela-
Raventós, 2014).
Os resultados mostram grande variabilidade de compostos fenólicos presents na
flor de Macroptilium lathyroides (L.) Urb.e sua concentração elevada como fontes
de fenólicos bioacessíveis com grande atividade antioxidante, mostrando uma
bioacessibilidade quando comparada à outras flores comestíveis, já estudadas. De
acordo com Pires et al. (2018), as flores podem conter uma variedade desses
antioxidantes naturais, como ácidos fenólicos e flavonóides, sendo sua presença
fortemente relacionada à sua cor, seja diretamente (por exemplo, antocianinas e
outros pigmentos flavonóides) ou indiretamente através dos processos de
copigmentação.
Os teores de fenólicos e antocianinas totais avaliados nos extratos obtidos de
M. lathyroides foram relativamente altos se comparado a outros estudos da
literatura. Através da análise do cromatograma, pôde-se verificar diferentes
compostos fenólicos, tais como, ácido clorogênico, ácido p-hidroxibenzóico,
Resveratrol, Quercetina e Orientina (Tabela 2).
De acordo com Santos, Galindo e Queiroz (2020); Benzaque (2009, esses compostos
possuem grandes propriedades antioxidantes e, além disso, ajudam a dimimuir os
níveis ruins de LDL, atuam no sistema central como calmante, sendo o resveratrol
um dos maiores antioxidantes da pele, a quercetina atuando como ação
cardiovascular, câncer, doenças neurodegenerativas, entre outros.
Destarte, estes dados podem contribuír para o conhecimento da atividade
biológica das flores vermelhas de M. lathyroides favorecendo a busca por novos
agentes terapêuticos e na possibilidade de outras aplicações, além das
medicinais, podendo ser utilizada na alimentação humana devido aos seus
potenciais benefícios à saúde.
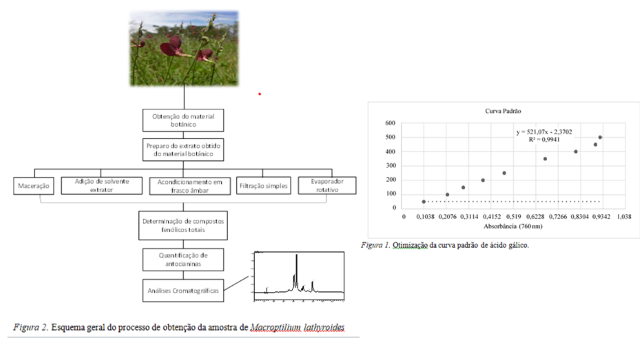
Figura 1. Otimização da curva padrão de ácido gálico; Figura 2. processo de obtenção da amostra utilizada para a determinação analítica instrumental.

Tabela 1 Média (x) do teor de polisfenóis e antocianinas totais; Figura 3. Cromatograma de HPLC – MS/MS; Tabela 2 Identificação por HPLC- MS/MS.
Conclusões
Os dados obtidos neste trabalho podem contribuír para o conhecimento da atividade
biológica das flores vermelhas de M. lathyroides favorecendo a busca por novos
agentes terapêuticos e na possibilidade de outras aplicações, além das medicinais,
podendo ser utilizada na alimentação humana devido aos seus potenciais benefícios
à saúde.
Agradecimentos
Ao IFPA/Campus Marabá Industrial. Ao CNPq (bolsista), à Faculdade de Química e
Biotecnologia – Universidade Federal do Pará, à Universidade do Estado do Pará
(UEPA, Marabá/PA), Universidade do Sul e Sudeste do Pará (UNIFESSPA).
Referências
BARROS, A. N., Cruz, R. C., Xavier, W. S., Carrieri, A. P., & Lima, G. C. O. (2011). Apropriação dos saberes administrativos: um olhar alternativo sobre o desenvolvimento da área. Revista de Administração Mackenzie, 12, 43-67.
BERLINCK, R. G. S., Borges, W. S., Scotti, M.T., Vieira. P. C. A. (2017). Química de Produtos Naturais do Brasil do Século XXI. Quimica Nova, 40(6):706-710. https://doi.org/10.21577/0100-4042.20170070.
BENZAQUEN, T. (2009). Dossiê antioxidants. Food Ingredients Brazil Nº 6, www.revista-fi.com.
Condori, M. B., Aro, J. M. A., Cáceres. A. E. M., Mendoza. J. R. (2020). Determinación de antocianinas y capacidad antioxidante en extractos de (Muehlembeckia volcanica). Revista de Investigaciones Altoandinas, 22(2):161-169. doi: http://dx.doi.org/10.18271/ria.2020.604.
DA SILVA, A. B., Wiest. J. M., Carvalho, H. H. C. (2016). Compostos químicos e atividade antioxidante analisados em Hibiscus rosa-sinensis L. (mimo-de-vênus) e Hibiscus syriacus L. (hibisco-da-síria). Brazilian Journal of Food Techology, 19:e 2015074. doi: http://dx.doi.org/10.1590/1981-6723.7415.
DA SILVA, J. J. M., Rogez, H. (2013). Avaliação da Estabilidade Oxidativa do Óleo Bruto de Açaí (Euterpe Oleracea Mart.) na Presença de Compostos Fenólicos Puros ou de Extratos Vegetais Amazônicos. Quimica Nova, 36(3):400-406. doi: https://doi.org/10.1590/S0100-40422013000300009.
DE PAULA, A. G. P., Heemann, A. C. W., Heemann, R., De Lima, C. P. (2019). Avaliação da estabilidade das antocianinas do açaí no período de 28 dias em diferentes condições. Brazilian Journal of health Review, 2(5):4811-4823. doi:10.34119/bjhrv2n5-078.
DI LECCE, G., Jáuregui, S. A. O., Tresserra-Rimbau, A. Quifer-Rada, P., Lamuela-Raventós, R. M. (2014). Phenolic profiling of the skin, pulp and seeds of albariño grapes using hybrid quadrupole time-of-flight and triple-quadrupole mass spectrometry. Food Chemistry, 145:874-882, doi: 10.1016 / j.foodchem.2013.08.115.
FERNANDES, L., Casal, S., Pereira, J. A., Saraiva, J. A., & Ramalhosa, E. (2017). Edible flowers: A review of the nutritional, antioxidant, antimicrobial properties and effects on human health. Journal of Food Composition and Analysis, 60, 38–50. http://dx.doi.org/10.1016/j.jfca.2017.03.017.
FERNANDES, L., Casal, S., Pereira, J. A., Saraiva, J. A., Ramalhosa, E. (2016). Uma Perspectiva nutricional sobre flores comestíveis. Acta Portuguesa de Nutrição, 6:32-37, doi: 10.21011 / apn.2016.060.
FLORES-Aguilar, E., Flores-Rivera, E. Del. P. (2018). Estabilidad de Antocianinas, Fenoles totales y Capacidad Antioxidante de Bebidas de Maíz Morado (Zea mays L.) y Uña de Gato (Uncaria tomentosa sp). Informacion Tecnologica, 29(2):75-184. doi: http://dx.doi.org/10.4067/S0718-07642018000200175.
FULEKI, T., Francis, F. J. (1968). Quantitative methods for anthocyanins: 2. Determination of total anthocyanins and degradation index for cranberry juice. Journal of Food Science, 33:78-83. doi: https://doi.org/10.1111/j.1365-2621.1968.tb00888.x.
Gonçalves, J., Silva, G. C. O., Carlos, L. A. (2019). Compostos bioativos em flores comestíveis. Perspectivas Online: Biológicas & Saúde, 9(29):11-20. doi: 10.25242/886892920191719.
GORDON, A., Cruz, A. P. G., Cabral, L. M. C., Freitas, S. C. F., Taxi, C. M. A. D., Donangelo, C. M. D., Mattietto, R. A., Friedrich, et al. (2012). Chemical characterization and evaluation of antioxidante properties of Açaí fruits (Euterpe oleraceae Mart.) during ripening. Food Chemistry, 133:256-263, doi: 10.1016/ j.foodchem.2011.11.150.
HURTADO, N. H., Charfuelan, C. (2019). Contribución a la Caracterización y Evaluación de la Actividad Antioxidante de las Antocianinas del Fruto de Ivilan (Monnina Obtusifolia H.B.K). Informacion Tecnologica, 30(5):81-90. doi: http://dx.doi.org/10.4067/S0718-07642019000500081.
LUCIANA, N. T., Stringheta, P. C., Oliveira, F. A. (2008). Comparação de métodos para quantificação de antocianinas. Revista Ceres, 55(4):297-304. doi: http://www.ceres.ufv.br/ojs/index.php/ceres/article/view/3320/1217.
RE, R.; Pellegrini, N.; Proteggente, A.; Pannala, A.; Yang, M.; Rice-Evans, C. (1999). Antioxidant activity applying in improved ABTS radical cation decolorization assay. Free radical Biology and Medicine, v.26, p.1231- 1237.
ROSSA, Ü. B., Angelo, A. C., Mazuchowski, J. Z., Westphalen, D. J., Frizon, C. N. T., Martins, C. E. N. (2017). Influência da Luminosidade e Fertilizantes nos Teores de Metilxantinas e Compostos Fenólicos em Folhas de Erva-Mate. Ciência Florestal, 27(4):1365-1374. doi: https://doi.org/10.5902/1980509830217.
PIRES, T.C.S.P, Dias, M. I., Barrosa, L., Calhelhaa, R. C., Alves, M. J., M., Oliveira B. P.P., Celestino Santos-Buelgab, Ferreira et al. (2018). Edible flowers as sources of phenolic compounds with bioactive potential. Food Research International 105 (2018) 580–588. https://doi.org/10.1016/j.foodres.2017.11.01.
SANTOS, A. P. M., Galindo, A. S., Queiroz, E. S. (2020). Propriedades neuropsicofarmacológicas, compostos quimicamente ativos e uso medicinal da passiflora incarnate. Brazilian Journal of Development. Curitiba, v. 6, n.12 p.94. DOI:10.34117/bjdv6n12-098.
SANTOS, J. A. S., Sena, T. J. O. Costa, M. L. A., Santos, K. C. B. S., Santos, A. F. (2018). Estudo do potencial antioxidante da Anacardium occidentales L. e determinação de seus compostos fenólicos. Diversitas Journal, 3(2):455-474. doi: https://doi.org/10.17648/diversitas-journal- v3i2.637.
Silva, M. S. M., Carneiro, M. S. S., Edvan, R. L., Santiago, F. (2017). Diferentes turnos de rega sobre o crescimento e produção de Macroptilium lathyroides (L.) Urb. Revista de Ciências Agrárias, 40(2):430-435. doi: 10.19084 / RCA16099.
SOUZA, H. A., Nascimnto, A. L. A. A., Stringheta, P. C., Barros, F. A. R. Antioxidant capacity of nasturtium (Tropaeolum majus L.) flowers. Revista Ponto de Vista, ISSN: 1983-2656 N.9 – vol. 1, p.73. https://periodicos.ufv.br/rpv.
SOUSA, L. M., Gois, R. W. S., Lemos, T. L. G., Arriaga, Â. M. C., Andrade-Neto, M., Santiago, G. M. P., Braz-Filho, R., Costa, et al. (2013). Constituintes Químicos e Avaliação da Atividade Antibacteriana de Macroptilium lathyroides (L.) Urb. (Fabaceae). Quimica Nova, 36(9):1370-1374. doi: http://dx.doi.org/10.1590/S0100-40422013000900016.
















