Autores
Castaño, L. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Cuellar, J. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Gil, J. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Durango, D. (UNIVERSIDAD NACIONAL DE COLOMBIA)
Resumo
El objetivo del trabajo fue evaluar la actividad antifúngica de la cumarina y
seis derivados contra L. theobromae, B. cinerea y F. oxysporum. Se determinó la
inhibición del crecimiento micelial (%) y el metabolismo de la cumarina
(experimento en el curso del tiempo). El crecimiento de los hongos fue
dependiente de la concentración y el tiempo. La inhibición de los hongos por la
cumarina varió entre 88.9-75.0% (B. cinérea), 66.4-24.8% (L. theobromae) y 78.8-
55.5% (F. oxysporum). La cumarina fue metabolizada en dos productos mayoritarios
(dihidrocumarina y ácido 3-(2-hidroxifenil) propanóico). Finalmente, la
modificación estructural de la cumarina en C-3 potencia la actividad antifúngica
contra L. theobromae en comparación con derivados sustituidos sobre el anillo
aromático de la cumarina.
Palavras chaves
Fungitoxicidad; bioreducción; dihidrocumarina
Introdução
Las cumarinas son moléculas heterocíclicas del tipo 1,2-benzopironas, también
conocidas como 2H-chromen-2-ones, que están presentes en una gran variedad de
pantas y exhiben diferentes propiedades biológicas y farmacológicas; en
particular, diversas cumarinas naturales y sus derivados son activas,
especialmente contra hongos y bacterias (BROOKER et al., 2008; FRANCO et al.,
(2021). Cumarinas presentes en los cítricos, como la escopoletina han sido
ampliamente estudiadas como fitoalexina, debido a que su acumulación ha sido
relacionada directamente con el incremento de resistencia frente a diferentes
patógenos (STASSEN et al., 2021). Otras cumarinas son compuestos antimicrobianos
constitutivos, y actúan como barrera química defensiva de la planta (FERNANDES
et al., 2022; STRINGLIS et al., 2019). En los países tropicales proliferan
hongos fitopatógenos que afectan diferentes clases de cultivos; conocer el
potencial de acción de cumarinas sobre hongos fitopatógenos es de particular
importancia debido a que estos microorganismos causan enfermedades y deterioro
durante la producción y la poscosecha, afectando la economía de productores,
comercializadores y consumidores. En el presente trabajo, se evaluó el efecto
fungiestático, junto con su metabolismo, de la cumarina contra tres hongos
fitopatógenos aislados de lima Tahití (Citrus latifolia T.). Adicionalmente, se
determinó el efecto de diferentes sustituyentes en la estructura de la cumarina
sobre la inhibición del hongo L. theobromae.
Material e métodos
Los hongos fitopatógenos Lasiodiplodia theobromae, Botrytis cinérea, y Fusarium
oxysporum se aislaron de frutos de lima Tahiti (Citrus latifolia T.), infectados
y con síntomas evidentes de deterioro. El seguimiento del metabolismo microbiano
de la cumarina y la purificación de los productos se realizó por cromatografía
liquida (CC, TLC y HPLC-DAD); mientras que la identificación de los productos
metabólicos y de síntesis se realizó a través de espectroscopia de Resonancia
Magnética Nuclear de 1H (300 MHz) y 13C (75 MHz). La actividad antifúngica de la
cumarina y los derivados se determinó a varias concentraciones por el método del
alimento envenenado (VELASCO et al., 2010) y se determinó la inhibición del
crecimiento (%). El metabolismo de la cumarina se realizó en el curso del
tiempo, se emplearon matraces agitados conteniendo el medio Czapeck-Dox y la
cumarina a concentración final de 250 µg/mL. Se prepararon cinco derivados de la
cumarina con patrones de sustitución en C-3 (acetil y carboxilato de etilo), C-4
(metil), C-7 (acetiloxi, hidroxi) y C-6 (nitro).
Resultado e discussão
La cumarina (1) presentó actividad antifungica significativa contra hongos a
concentraciones > de 1.5 mM. La inhibición fue dependiente de la concentración y
el tiempo, con valores de 75.9% (B. cinérea), 55.5% (F. oxysporum) y 24.8% (L.
theobromae). MONTAGNER et al. (2008) reportaron fungitoxicidad de la cumarina
contra A. fumigatus y F. solani. La biotrasformación de (1) por L. theobromae
generó dos compuestos mayoritarios (dihidrocumarina (2) y ácido 3 (2-
hidroxifenil) propanóico (3)). Posiblemente, la cumarina se metabolizó por la
acción de ene-reductasas e hidrolasas para obtener (2) y (3) (SERRA et al.,
2019). QIN et al (2020) señalaron que el esqueleto 1,2 benzopironas es esencial
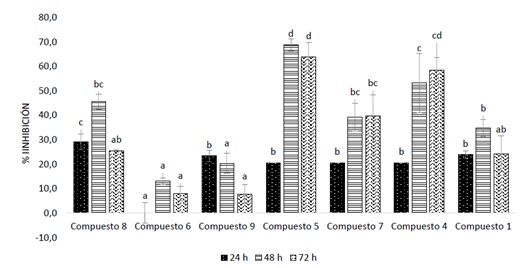
para la actividad antimicrobiana. Los derivados (4 a 9) inhibieron L. theobromae
entre el 10-70% (Figura 1).
Figura 1. Inhibición (%) del crecimiento radial de L. theobromae con las
cumarinas (1 a 9).
Los derivados sustituidos en C-3 (acetilcumarina (4) y cumarina-3-carboxilato de
etilo (5)) fueron ~2.5 veces más activos que (1). Se infiere que modificaciones
en el sistema α, β-insaturado puede evitar la reducción por las ene-reductasas.
SAHOO et al (2021), sugieren que sustituyentes en C-3 y C-4 son apreciados para
el desarrollo de nuevos agentes antimicrobianos. Los compuestos oxigenados en C-
7 (7-hidroxicoumarina (9) y 7-acetiloxicumarina (6)), fueron los menos activos.
Este resultado difiere de NJANKOUO et al. (2020) quienes encontraron alta
actividad asociada a la escopoletina (hidroxilada en C-7). El derivado (7),
sustituido en C-3 (metilo) y C-7 (hidroxilo) exhibió mayor actividad antifúngica
que (6) y (9). El compuesto 6-nitrocumarina (8), mostró un leve aumento de la
actividad; el grupo atrayente de electrones no incrementó notablemente la
actividad antifúngica respecto a (1).
Inhibición (%) del crecimiento radial de L. theobromae con las cumarinas (1 a 9).
Conclusões
La cumarina exhibió una actividad antifúngica de moderada a baja contra B.
cinerea, L. theobromae y F. oxysporum; la detoxificaron del compuesto fue
dependiente del tiempo y la concentración. Las semejanzas estructurales presentes
entre los derivados cumarinicos que exhibieron la menor (6 y 9, con sustituciones
en la posición 7) y la mayor actividad (4 y 5, sustituidos en la posición 3,)
permiten inferir que algunas características estéricas en el doble enlace, y
electrónicas en el anillo aromático, pueden influenciar positiva y negativamente
la actividad antifúngica contra L. theobromae.
Agradecimentos
Este trabajo fue soportado por la Universidad Nacional de Colombia (201010027028,
Hermes 50200)
Referências
BROOKER, N., WINDORSKI, J., BLUML, E. Halogenated coumarin derivatives as novel seed protectants. Commun Agric Appl Biol Sci., n.73, 87-89, 2008.
FERNANDES, H. P., SALOMÉ-ABARCA, L. F., GONÇALVES PEREIRA, R., BRANDÃO SEIBERT, J., SILVA-JUNIOR, G. J., DAS GRAÇAS FERNANDES DA SILVA, M. F., CHOI, Y. H.. Metabolomic Investigation of Citrus latifolia and the Putative Role of Coumarins in Resistance to Black Spot Disease. Frontiers in Molecular Biosciences, n. 645, 2022.
FRANCO, D. P., PEREIRA, T. M., VITORIO, F., NADUR, N. F., LACERDA, R. B., KÜMMERLE, A. E. A importância das cumarinas para a química medicinal e o desenvolvimento de compostos bioativos nos últimos anos. Química Nova, n. 44, 180-197, 2021.
MONTAGNER, C., DE SOUZA, S. M., GROPOSO, C., DELLE MONACHE, F., SMÂNIA, E. F., SMÂNIA JR, A.). Antifungal activity of coumarins. Zeitschrift für Naturforschung C, n. 63, 21-28, 2008.
NJANKOUO, N. Y., NYEGUE, M. A., MOUNJOUENPOU, P., KANSCI, G., KENFACK, M. J., EUGÈNE, E. E. LC‐MS quantification of scopoletin in cassava (Manihot Esculenta Crantz) varieties, local derived foods, and activity on some food spoilage fungi. Journal of Food Processing and Preservation, n. 44), e14387, 2020.
QIN, H. L., ZHANG, Z. W., RAVINDAR, L., RAKESH, K. P. Antibacterial activities with the structure-activity relationship of coumarin derivatives. European journal of medicinal chemistry, n. 207, 112832, 2020.
SAHOO, C. R., SAHOO, J., MAHAPATRA, M., LENKA, D., SAHU, P. K., DEHURY, B., PAIDESETTY, S. K. Coumarin derivatives as promising antibacterial agents. Arabian Journal of Chemistry, n.14, 102922, 2021.
SERRA, S., CASTAGNA, A., & VALENTINO, M. Biocatalytic synthesis of natural dihydrocoumarin by microbial reduction of coumarin. Catalysts, n. 9, 665, 2019.
STASSEN, M. J., HSU, S. H., PIETERSE, C. M., STRINGLIS, I. A. Coumarin communication along the microbiome–root–shoot axis. Trends in Plant Science, n. 26, 169-183, 2021.
STRINGLIS, I. A., DE JONGE, R., PIETERSE, C. M. The age of coumarins in plant–microbe interactions. Plant and Cell Physiology, n. 60, 1405-1419, 2019.
VELASCO, R., ARISTIZABAL, D. A., GARCÍA, C. M., GIL, J. H., DURANGO, D. L. Biotransformación de trans-cinamaldehído con el hongo filamentoso Aspergillus sp. Vitae, n. 17, 281-290, 2010.
















