Autores
Nogueira, P.A.D. (UFAM/ INPA) ; Santos, H.C. (UFAM/ INPA) ; Souza, P.B.A. (UFAM/ INPA) ; Ramos, H.G. (UFAM/ INPA) ; Lima, J.A.O. (UFAM/ INPA) ; Oliveira, D.S. (UFAM/ INPA) ; Oliveira, M.V.S. (UFAM) ; Nascimento, C.C. (INPA) ; Lima, M.P. (INPA)
Resumo
A família Meliaceae é reportada como fonte rica em metabólitos secundários.
Estudos fitoquímicos do gênero Cedrela revelam compostos como ácidos
alifáticos e álcoois, flavonóides, tocoferol, mono, sesqui e triterpenos,
esteróides e limonóides. Esse trabalho teve como objetivo conhecer o perfil
químico dos resíduos madeireiros de C. odorata. Os fracionamentos
cromatográficos do extrato metanólico foram efetuados em colunas abertas com
suportes variados de sephadex LH-20 e sílica gel-60, fornecendo uma mistura que
foi elucidada por análises de RMN em 1 e 2D, em comparação com a literatura,
permitindo a identificação da mistura epimérica dos poliacetilenos 1α e
1β (4,6-heptadecadiyne-3,9,10,11-tetraol). Este é o primeiro relato de um
poliacetileno neste genero.
Palavras chaves
cedro-rosa; madeiras de demolição; poliinos
Introdução
A fitoquímica da madeira está diretamente relacionada as suas propriedades
tecnológicas e proteção contra xilófagos sendo importantes para definir a forma
mais adequada para seu uso, e pode ser dividida em metabólitos primários e
secundários (SEVERO et al, 2006; KLOCK et al, 2005). Os metabólitos secundários
encontrados em diversas madeiras agregam valor à elas, e auxiliam na busca de
novas aplicações dos seus rejeitos, além de proporcionar conhecimento sobre o
perfil químico de espécies que são protegidas por lei (GRANATO et al, 2005). Por
muito tempo, as madeiras de algumas espécies de meliáceas, especialmente dos
gêneros Cedrela e Swietenia, foram exploradas exaustivamente em todo o
mundo para serem utilizadas principalmente na construção civil e fabricação de
móveis finos, o que levou ao esgotamento de muitas de suas populações naturais
em diversas regiões do planeta (O’NEILL et al, 2001; LAURANCE, 1999; VERISSIMO
et al, 1998; KEAY, 1996; MABBERLEY et al, 1995).
A família Meliaceae possui cerca 58 gêneros e 740 espécies, divididos em duas
subfamílias, Melioideae, e Cedreloideae, cujo gênero mais representativo, desta
última, é o Cedrela com 18 espécies e possui distribuição por toda a região
Pantropical (APG, 2022). A família tem inúmeros registros de estudos
fitoquímicos em diversas partes vegetativas, mas com bastante restrição aos
estudos relacionados à madeira. Estudos fitoquímicos no gênero Cedrela
revelam diversos compostos como como ácido alifático e álcool, flavonóides,
tocoferol, monoterpenos, sesquiterpenos, triterpenos cicloartanos, esteróides e
limonóides (NOGUEIRA et al, 2020). Embora os metabólitos secundários dessa
família sejam bastante reportados, algumas classes como poliacetileno por
exemplo, apresenta poucos registros.
Das plantas superiores, mais de mil poliacetilenos foram isolados em
aproximadamente 21 famílias. Recentemente, essa classe de compostos, muitas
vezes instáveis, contendo pelo menos uma ligação tripla carbono-carbono que já
demonstrou possuir potente atividade imunossupressora seletiva e baixa
citotoxicidade também foram encontrados na família Meliaceae (NENG et al, 2019;
WANG et al, 2018; WANG et al, 2014; ZHANG et al, 2012; NING et al, 2011; MINTO e
BLACKLOCK, 2008; WAKABAYASHI et al, 1991). Devido à presença de diferentes
ligações do tipo alquinil, os poliacetilenos tornam-se atraente devido às suas
estruturas intrigantes, bioatividades significativas e modos surpreendentes de
biossíntese (WANG et al, 2018; MINTO e BLACKLOCK, 2008).
No presente trabalho, apresentamos o isolamento e elucidação estrutural de um
novo poliacetileno, ressaltando que essa classe de substancia é inédita para o
gênero Cedrela.
Material e métodos
As investigações fitoquímicas foram conduzidas no Laboratório de Química de
Produtos Naturais (LQPN) do Instituto Nacional de Pesquisas da Amazônia (INPA).
A obtenção dos resíduos madeireiros, oriundos de demolição de um prédio do INPA
com cerca de quarenta e cinco anos de uso em estrutura de esquadria de janelas,
foram cedidos pelo Laboratório de Tecnologia da Madeira (LTM) do INPA, para
serem submetidos à investigação fitoquímica.
Os resíduos madeireiros foram moídos em moinho de facas e submetidos a uma
extração a frio em metanol por sete dias, dando origem ao extrato metanólico. O
fracionamento cromatográfico inicial foi efetuado em coluna cromatográfica
aberta utilizando sílica gel tipo filtrante (70-230 mesh) empregando diferentes
gradientes de polaridade dos solventes, partindo do Hexano à MeOH, originando 28
frações. As frações obtidas foram analisadas por coluna cromatográfica delgada
comparativa-CCDC e submetidas a novos procedimentos de purificação. A água-mãe
da fração COM-16 foi refracionada diversas vezes, fornecendo a Substância 1α
e 1β codificada como COM-16H.3.8.7.5 (6 mg, figura 01), possuindo
aspecto de óleo com aroma agradável. Em CCDC apresentou-se como uma florescência
fraca na UV 254nm e como uma mancha de cor violeta ao ser revelada em vanilina
sulfúrica.
Para identificação dessa substância realizou-se análises de RMN 1H
13C, DEPT 135, HSQC, HMBC, COSY e NOESY em espectrômetros da Bruker,
modelos AVANCE III HD (500 MHz -1H e 125 MHz - 13C) e
Fourier-300 (300 MHz - 1H e 75 MHz - 13C), além da
espectrometria de massas (EM) em espectrômetro da Bruker, modelo microTOF-Q II,
analisador time of flight. Fonte ESI em modo positivo com resolução de
17500 (FWHM), utilizando-se o programa Compass, versão 4.1, para
controle, aquisição e processamento de dados.
Resultado e discussão
Elucidação estrutural das substâncias
A fração COM-16H.3.8.7.5 (6 mg), denominada de mistura isomérica das substâncias
1α e 1β (fig. 2) obtida após os fracionamentos cromatográficos apresentado na
fig. 1, demonstrou possuir aspecto oleoso, cor laranja amarelado, polar, cheiro
forte amadeirado. Em CCDC apresentou-se pura como uma mancha única de cor
violeta ao ser revelada em vanilina sulfúrica e uma florescência visível em luz
UV com comprimento de onda de 254nm.
As substancias 1α e 1β foram caracterizadas com base nos dados de RMN uni
e bidimensionais e espectrometria de massas de alta resolução (EMAR) no modo
positivo de ionização. As análises em LC-MS, indicaram um pseudo-íon equivalente
a uma mistura epimérica com pico [M+H]+ m/z 297,2052 sugerindo a fórmula
molecular C17H29O4. No espectro de RMN
1H, foram observadas a presença de dois sinais de hidrogênios
característicos de metilas na região entre ᵟH 0,96 (t, J = 7,45 Hz; H-1) e 0,88
(t, J = 6,63 Hz; H-17). Ainda foi possível observar quatro sinais de hidrogênio
dos carbonos metínicos em ᵟH 4,29 (t, J = 6,0 Hz; H-3), 4,08 (m; H-9), 3,33 e
3,39 (d, J = 7,1 Hz e t, J = 3,4 Hz; H-10), 3,62 e 3,86 (m; H-11) e os
metilenicos em ᵟH 2,55 e 2,67 (dd, J = 6,4-6,6 e 17,2-17,1 Hz; H-8). O COSY
possibilitou a confirmação dos acoplamentos de H-8 à H-17, bem como os de H-1 à
H-3 (fig. 2).
Os espectros de RMN de 13C mostraram sinais referentes a 17 carbonos,
incluindo dois metílicos (C-1 e C-17), sete metilenicos (C-2, C-8, C-12 a C-16),
quatro metínicos (C-3, C-9 a C-11), quatro carbonos desidrogenados (C-4 a C-7).
Com base no DEPT 135 foi possível confirmar os carbonos dos grupos acetilenos de
ᵟC 78,99 e 79,27 (C-4), 69,38 e 69,32 (C-5), 66,54 e 66,40 (C-6), 78,99 e 78,94
(C-7). O mapa de contorno HSQC (fig. 2) mostrou a correlação do H-3 com o
carbono metínico em ᵟC 63,81(C-3), além dos H-9, H-10 e H-11 com os carbonos
metínicos em ᵟC 70,17 (C-9), 75,24 e 74,78 (C-10) e 72,82 e 72,22 (C-11). O mapa
de contorno HMBC (fig. 2) mostrou as correlações do H-3 com os carbonos em ᵟC
9,89 (C-1), 31,70 (C-2), 78,99 e 79,27 (C-4), 69,38 e 69,32 (C-5), 66,54 e 66,40
(C-6), também são observadas as correlações entre os H-8 como os carbonos em ᵟC
66,54 e 66,40 (C-6), 78,99 e 78,94 (C-7), 70,17 (C-9), 75,24 e 74,78 (C-10) e
72,82 e 72,22 (C-11).
As analises 1D e 2D aliadas aos dados de EMAR, possibilitaram a identificação da
mistura de dois estereoisômeros pertencentes a classe dos poliacetilenos e foram
comparados com os dados de RMN 1H e 13C do
dihydropanaxacol (FUJIMOTO e SATOH, 1987). Esses poliacetilenos foram
identificados como 4,6-heptadecadiyne-3,9,10,11-tetraol (1α) e 4,6-
heptadecadiyne-3,9,10,11-tetraol (1β), respectivamente.
Recentemente foram identificados alguns poliacetilenos na família Meliaceae,
isoladas nos gêneros Swietenia (NENG et al, 2019; WAKABAYASHI et al,
1991), Toona (WANG et al, 2018; NING et al, 2011) e Khaya (WANG et
al, 2014; ZHANG et al, 2012). Este, porém é o primeiro registro de isolamento de
um poliacetileno para o gênero Cedrela.

Imagem mostra o esquema dos fraciomanentos ao lado dos residuos madeireiros de C. odorata.
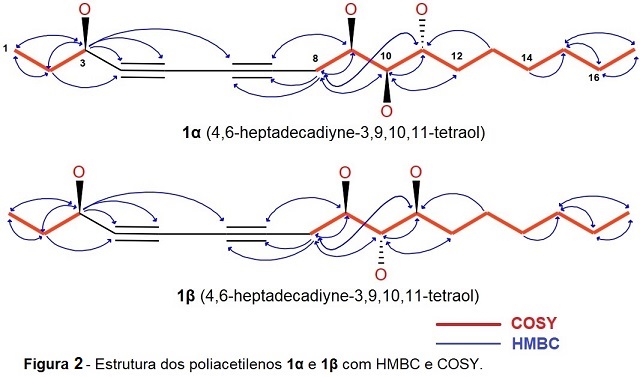
A imagem demonstra a provavel configuração espacial das moleculas elucidadas e suas correlações no mapa de contorno HMBC e acoplamentos no COSY.
Conclusões
Os dois poliacetilenos isolados e identificados a partir dos resíduos madeireiros
de C. odorata são os primeiros relatos desses compostos na literatura e também no
gênero Cedrela. Nesse sentido os estudos fitoquímicos a partir de resíduos
madeireiros demonstram contribuir na busca por novos compostos com possíveis
potenciais biológicos.
Agradecimentos
Ao INPA, FAPEAM, Projeto INCT Madeiras da Amazônia, LTM, LQPN e UFAM.
Referências
APG (Angiosperm Phylogeny Group). Disponível em: <http://www.mobot.org/MOBOT/ research/APweb/>. Acesso em 18 jul 2022.
FUJIMOTO, Y e SATOH, M. Acetylenes from the callus of Panax ginseng. Phytochmistry, Vol. 26 (10): 2852-2854, 1987.
GRANATO, D.; NUNES, D.S.; MATTOS, P.P.; RIOS, E.M.; GLINSKI, A.; RODRIGUES, L.C.; JÚNIOR, G.Z. Chemical and biological evaluation of rejects from the wood industry. Brazilian archives of biology and technology, 48: 237- 241, 2005.
HAYASIDA, W.; SOUSA, A. S.; LIMA, M. P.; NASCIMENTO, C. C.; FERREIRA, A.G. Proposta de aproveitamento em resíduos de pau-rainha (Brosimum rubescens) descartados pelo setor madeireiro. Acta Amazonica, 38 (4): 749-752, 2008.
KEAY, R.W.J. The future of the genus Swietenia in its native forest. Botanical Journal of the Linnean Society, 122: 3–7, 1996.
KLOCK, U.; MUÑIZ, G.I.B.; HERNANDEZ, J.A.; ANDRADE, A.S. Química da madeira. Curitiba, PR: Universidade Federal do Paraná. 22p, 2005.
LAURANCE, W.F. Reflections on the tropical deforestation crisis. Biological Conservation, 91: 109–117, 1999.
MABBERLEY, D.J.; PANNELL, C.M.; SING, A.M. Meliaceae. Flora Malesiana Series I, Leiden, n. 12, p. 1-407, 1995.
MAGALHÃES, L.A.M. Avaliação dos constituintes químicos de Guarea convergens, G. scabra, G. silvatica (voláteis) e G. humaitensis (fixos e voláteis) e atividade sobre Aedes aegypti. Dissertação (Mestrado em Química). Universidade Federal do Amazonas, Manaus, Amazonas, 122p., 2010.
MELO, L.E.S. Estudo químico de resíduos madeireiros de Tabebuia serratifolia (Vahl) G. Nicholson, Acacia mangium Willd. E Dipteryx polyphylla Huber. Tese (Doutorado em Química). Universidade Federal do Amazonas, Manaus, Amazonas, 188p, 2016.
MINTO, RE e BLACKLOCK, BJ. Biosynthesis and function of polyacetylenes and allied natural products. Prog Lipid Res. 47(4):233–306, 2008.
NING, J; DI, YT; LI, SF; GENG, ZL; HE, HP; WANG, YH; WANG, YY; LI, Y; LI, SL; HAO, XJ. Polyynes from Toona ciliata var. ciliata and related cytotoxic activity. Helv Chim Acta. 94(3):376–381, 2011.
NOGUEIRA, T.S.R.; PASSOS, M.S.P.; NASCIMENTO, L.P.S.; ARANTES, M.B.S.; MONTEIRO, N.O.; BOENO, S.I.S.; JUNIOR, A.C.; AZEVEDO, O.A.; TERRA, W.S.; VIEIRA, M.G.C.;
BRAZ-FILHO, R. e VIEIRA, I.J.C. Chemical Compounds and Biologic Activities: A Review of Cedrela Genus. Molecules, 25, 5401, 2020.
O’NEILL, G.A.; DAWSON, I.; SOTELO-MONTES, C.; GUARINO, L.; GUARIGUATA, M.; CURRENT, D.; e WEBER, J.C. Strategies for genetic conservation of trees in the Peruvian Amazon. Biodiversity and Conservation, 10: 837–850, 2001.
SEVERO, E.T.D.; CALONEGO, F.W.; SANSÍGOLO, C.A. Composição química da madeira de Eucalyptus citriodora em função das direções estruturais. Silva Lusitana, 14: 113-126, 2006.
VERISSIMO, A.; SOUZA-JUNIOR, C.; STONE, S. e UHL, C. Zoning of timber extraction in the Brazilian Amazon. Conservation Biology 12: 128–136, 1998.
WAKABAYASHI, N.; SPENCER, S.L.; WATERS, R.M.; LUSBY, W.R. A Polyacetylene from Honduras Mahogany, Swietenia mahagoni. J. Nat. Prod., 54, 1419–1421. 1991.
WANG, Y.; LIU, Q.F.; XUE, J.J.; ZHOU, Y.; YU, H.C.; YANG, S.Y.; ZHANG, B.; ZUO, J.P.; LI, Y.; YUE, J.M. Ivorenolide B, an immunosuppressive 17-membered macrolide from Khaya ivorensis: structural determination and total synthesis. Org. Lett., 16, 2062–2065, 2014.
WANG, R.; NI, F.Q.; SANG, J.; ZHANG, Y.; HUANG, J.L.; YIN, S. & TANG, G.H. Toonapolyynes A–D, new polyynes from Toona ciliata, Natural Product Research, 34, 935942, 2018.
ZHANG B, WANG Y, YANG SP, ZHOU Y, WU WB, TANG W, ZUO JP, LI Y, YUE JM. Ivorenolide A, an unprecedented immunosuppressive macrolide from Khaya ivorensis: Structural elucidation and bioinspired total synthesis. J Am Chem Soc. 134(51):20605–20608, 2012.
















