Autores
Martins, D. (LABCSI-UFF) ; Lopes, G. (IFRJ, LABCSI-UFF) ; Hiller, N. (LABCSI-UFF)
Resumo
Pirazolonas são heterociclos presentes em diversos medicamentos, o que evidencia o
potencial farmacológico deste núcleo químico. A 5-pirazolona possui em sua
estrutura um metileno ativo, ou seja, um metileno com hidrogênios ácidos devido ao
efeito dos grupos retiradores de elétrons (GRE) aos quais está ligado. Desta
maneira, as 5-pirazolonas foram utilizadas em reações de Knoevenagel para obtenção
de 4‑arilideno‑3‑metil‑1‑fenil-5‑pirazolonas em bons rendimentos, tais compostos
possuem potencial atividade biológica e foram caracterizadas por 1H-RMN e
espectroscopia na região do IV.
Palavras chaves
Aceptores de Michael; α,β-insaturados; Química verde
Introdução
As pirazolonas são heterociclos de 5 membros derivados do pirazol, onde um dos
carbonos do anel é uma carbonila (C=O). Dentre as pirazolonas, as 5-pirazolonas
são as de maior importância farmacológica. Elas podem existir sob diferentes
formas tautoméricas (Figura 1A) (ASIF et al, 2021).
As pirazolonas têm sido o alvo de pesquisas na área de química medicinal há
mais de um século (ZHAO et al, 2020). Inclusive, essas estruturas estão
presentes em diferentes medicamentos aprovados pelo FDA (Food and Drug
Administration), tais como antipirina 3, dipirona 4, nifenazona 5 e edaravone 6
(Figura 1B) (ZHAO et al, 2020).
Compostos carbonilados ,-insaturados são aceptores de Michael, os quais podem
ser atacados na posição por uma cisteína presente no sítio ativo de cisteíno
proteases. Sendo assim, os aceptores de Michael podem ser warheads (grupos
reativos) úteis para o desenvolvimento de inibidores de cisteíno proteases que
sejam alvos moleculares na terapia de doenças como a osteoporose, câncer e
doença de Chagas, por exemplo (SANTOS et al, 2007).
Compostos carbonilados ,-insaturados podem ser gerados através da condensação
de Knoevenagel entre um aldeído ou cetona e um composto contendo um metileno
ativo. A reação de Knoevenagel é comumente catalisada por aminas secundárias,
como a piperidina em solventes como etanol e tolueno. Outros catalisadores
também foram relatados na literatura (METWALLY et al, 2012).
Uma estratégia da Química Verde com a finalidade de minimizar os problemas
relativos à manufatura, segurança, custo, manuseio, estoque e transporte de
solventes é a reação sem solventes (DA SILVA et al, 2005). Desta forma, no
presente trabalho, procurou-se estudar a reação de Knoevenagel entre diferentes
aldeídos e a a 1-fenil-3-metil-5-pirazolona através de um processo sem solvente,
a fim de gerar aceptores de Michael com potencial atividade inibitória de
cisteíno proteases de forma a atender os princípios da Química Verde.
Material e métodos
Preparou-se a 1-fenil-3-metil-5-pirazolona 9 pela reação entre o acetoacetato de
etila 7 e a fenilhidrazina 8 (Esquema 1A), empregando diferentes catalisadores,
através de reações sem solvente a 130 °C (Tabela 1). Posteriormente, foram
preparadas pirazolonas ,-insaturadas, através da condensação de Knoevenagel
entre aldeídos aromáticos e a pirazolona 9 em reações sem solvente pelo método da
fusão (Esquema 1B) (RADI et al, 2009). O progresso da reação foi acompanhado por
cromatografia em camada fina (c.c.f). Os produtos obtidos foram caracterizados por
1H-RMN e espectroscopia na região do IV e seus pontos de fusão capilares não
corrigidos foram determinados.
Resultado e discussão
A 1-fenil-3-metil-5-pirazolona 9 foi obtida sob diferentes condições de reação
sem emprego de solventes (Tabela 1). O acompanhamento das reações por
cromatografia em camada fina permitiu verificar que o uso do acetato de potássio
resultou em reações mais limpas (sem subprodutos) do que a reação catalisada
por DABCO (1,4-diazabiciclo[2.2.2]octano) (Tabela 1, Entrada 1 x Entrada 3). Em
ambas as reações catalisadas, o produto foi obtido em menos tempo com respeito à
reação não catalisada (Entrada 4). Nas reações catalisadas, o consumo total dos
reagentes foi verificado com 45 min de reação. Os rendimentos isolados foram
baixos. O ponto de fusão verificado para o composto 9 foi 127-129 °C, o que está
de acordo com a literatura. (XU et al, 2011)
Pirazolonas insaturadas 10a-g, 4‑arilideno‑3‑metil‑1‑fenil-5‑pirazolonas,
foram obtidas por condensação de Knoevenagel pelo método da fusão, em reações
sem solventes (Esquema 1B). As 5-pirazolonas 10a-g foram obtidas em
rendimentos elevados (R > 70%) (Esquema 1B). Os produtos 10a-g foram
caracterizados por 1H-RMN e por IV. No espectro de 1H-RMN, observou-se um
simpleto correspondente ao hidrogênio vinílico característico dos compostos α,β-
insaturados, com deslocamento químico entre 7,3-9,2 ppm. Também foi observado o
desaparecimento do sinal dos hidrogênios do metileno ativo da pirazolona 9,
observado em 3,42 ppm.
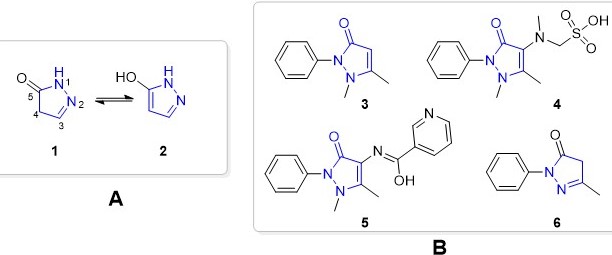
5-pirazolonas: formas tautoméricas (A) e exemplos de fármacos que contém este núcleo heterocíclico (B)
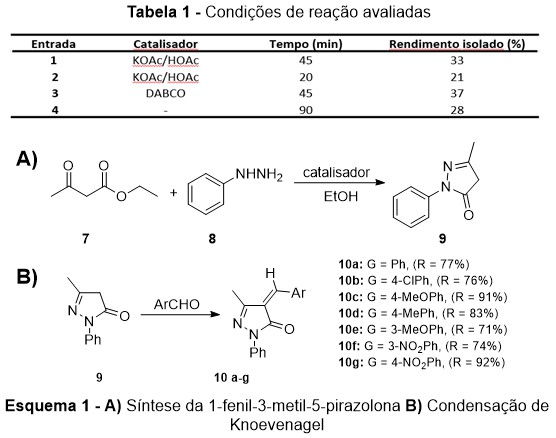
Esquema 1- A) Síntese da 1-fenil-3-metil-5- pirazolona B) Condensação de Knoevenagel
Conclusões
Neste trabalho, foram preparadas 4‑arilideno‑3‑metil‑1‑fenil-5‑pirazolonas em
duas etapas, ambas realizadas sob o método da fusão como reações sem solventes:
obtenção da 1-fenil-3-metil-5-pirazolona, seguida da sua condensação com aldeídos
aromáticos. Foram explorados diferentes catalisadores na síntese da 1-fenil-3-
metil-5-pirazolona, a qual foi obtida em baixo rendimento. As reações de
Knoevenagel forneceram as 4‑arilideno‑3‑metil‑1‑fenil-5‑pirazolonas em bons
rendimentos e a formação destes produtos pôde ser confirmada pela presença do
sinal do hidrogênio vinílico como um simpleto nos espectros de 1H-RMN.
Agradecimentos
APQ-1/FAPERJ (E-26/010.001861/2019), PPGQ-
UFF, PROPPI-UFF (EDITAL FOPESQ-2022).
Referências
ASIF, M.; IMRAN, M.; HUSAIN, A. Approaches for chemical synthesis and diverse pharmacological significance of pyrazolone derivatives: a review. Journal of the Chilean Chemistry Society, no 2, 5149-5163, 2021.
DA SILVA, F. M.; DE LACERDA, P. S. B.; JUNIOR, J. J. Desenvolvimento sustentável e química verde. Química nova, v. 28, 103-110, 2005.
METWALLY, M. A.; BONDOCK, S. A.; EI-DESOUKY, S. I.; ABDOU, M. M. ChemInform Abstract: Pyrazol-5-ones: Tautomerism, Synthesis and Reactions. International Journal of Modern Organic Chemistry, v. 1, 19-54, 2012.
RADI, M.; et al. Microwave-assisted organocatalytic multicomponent Knoevenagel/hetero Diels–Alder reaction for the synthesis of 2,3-dihydropyran[2,3-c]pyrazoles. Tetrahedron Letters, v. 50, 6572-6575, 2009.
SANTOS, M. M. M.; MOREIRA, R. Michael Acceptors as Cysteine Protease Inhibitors. Mini-Reviews in Medicinal Chemistry, v. 7, 1040-1050, 2007.
XU, C. -J.; SHI, Y. -Q. Synthesis and Crystal Structure of 5-Chloro-3-Methyl-1-Phenyl-1H-Pyrazole-4-Carbaldehyde. Journal of Chemistry Crystallography, v. 41, 1816-1819, 2011.
ZHAO, Z. et al. Pyrazolone structural motif in medicinal chemistry: Retrospect and prospect. European Journal of Medicinal Chemistry, v. 186, 1-25, 2020.
















