Autores
Sete da Cruz, R.M. (UEM) ; Mataruco, L. (UEM) ; Jaski, J.M. (UEM) ; Barão, C.E. (UEM / IFPR)
Resumo
A Pereskia aculeata Mill. (Ora-pro-nóbis) é uma espécie da família
Cactaceae e faz parte da classificação de hortaliças não-convencionais. Estudos
demonstram que as folhas de ora-pró-nobis possuem grande quantidade de ácidos
fenólicos. O objetivo do trabalho foi definir as melhores condições de vazão,
pressão e temperatura na extração com etanol pressurizado das folhas de ora-pro-
nóbis, além de determinar a atividade antioxidante dos extratos e quantificar o
teor de proteínas e compostos fenólicos. Através dos resultados obtidos verificou-
se que a condição de 60 °C, 50 bar e 0,5ml min-1 forneceu os melhores
valores em relação aos compostos fenólicos (2.60± 0.08) e menores valores de IC50
(154.78 ± 4.53).
Palavras chaves
Pereskia aculeata Mill; eco friendly process; plantas não-convencionais
Introdução
Algumas espécies de plantas nativas constituem uma alternativa para a obtenção
de compostos fenólicos como, por exemplo, as folhas de Pereskia aculeata
Miller, da família Cactaceae, subfamília da Pereskioideae e conhecida
como Ora-pró-nobis (OPN) (XAVIER, 2022). Garcia et al. 2019 relata que os
compostos fenólicos e carotenóides são os principais constituintes antioxidantes
das folhas de OPN, sendo elas macias, de cor verde-escura, carnosas e
suculentas, e constituem a parte da planta mais utilizada para consumo humano,
podendo ser consumidas cruas ou cozidas sendo classificadas como plantas
alimentícias não-convencionais (PANC) (OLIVEIRA; NAOZUCA, 2021).
Os compostos fenólicos são partes de metabólitos secundários encontrados
principalmente em espécies de plantas com enorme diversidade estrutural. Esses
compostos não são distribuídos universalmente nas plantas com estabilidade
variada. Isso contribuiu para desafiar os processos de extração; implicando que
o emprego de uma única etapa ou técnica de extração inadequada pode alterar a
recuperação de componentes fenólicos das amostras de plantas. Portanto, é
importante selecionar um método de extração apropriado para recuperar os
compostos fenólicos alvo (ALARA et al., 2021).
Para obtenção desses compostos fenólicos, podemos utilizar como uma das técnicas
atuais o método de extração com líquido pressurizado (PLE) também chamada de
“extração acelerada por solvente (ASE)” que requer o uso de alta temperatura e
pressão (ALARA et al., 2021).
Assim, os solventes de extração, tal como a água, que não é tão eficiente em
extrair compostos em baixas temperaturas, pode ser muito mais eficiente para as
temperaturas elevadas usadas no PLE (HEO et al., 2014), porém vários solventes e
suas misturas têm sido utilizados para a extração de componentes fenólicos
através de diversas fontes, sendo os mais utilizados o metanol, etanol e sua
combinação com água em várias proporções (ALVAREZ-RIVERA et al., 2020).
Quando comparada às técnicas de extrações convencionais, a PLE apresenta as
seguintes vantagens: maior rendimento, rapidez (10 a 30 minutos), economia de
solventes, não requer filtração do extrato e é automatizada (CASTRO-PUYANA et
al., 2013). Esse processo oferece uma série de vantagens em termos de
rendimento, produtividade e seletividade, além de redução do uso de solventes
químicos se tornando um dos principais “eco friendly process” (CHEMART e
KHAN, 2011).
Os objetivos desse trabalho foi realizar a extração de compostos fenólicos da
folha de ora-pro-nóbis utilizando etanol como agente extrator pela técnica de
líquido pressurizado.
Material e métodos
Preparação da matéria-prima: As folhas no mesmo estágio de maturação foram
limpas, armazenadas em sacos plásticos sob refrigeração e secas em liofilizador
para obtenção do produto em pó.
Extração de compostos fenólicos com etanol pressurizado: As condições de
extração com o sistema pressurizado utilizando etanol foram determinadas
utilizando um planejamento fatorial do tipo 23 com 3 pontos centrais.
Sendo as variáveis temperatura (30, 45 e 60 °C), pressão (50, 75 e 100 bar) e
fluxo (0,5, 0,75 e 1,0 mL . min-1).
Para a extração, primeiramente 4g de folhas secas e moídas foram adicionadas ao
recipiente extrator (célula de extração), a passagem do etanol será iniciada nas
condições de pressão, temperatura e vazão desejadas. O tempo de extração para
determinar a cinética de extração foi de 5 horas para cada condição.
Ao final de cada intervalo de tempo de extração, os frascos contendo extrato
etanólico foram colocados em estufa com circulação de ar a 55 ºC para secagem
até peso constante. Após a secagem, o extrato foi pesado em uma balança
analítica para determinação do rendimento obtido em massa. Para as curvas
cinéticas de extração os frascos foram pesados após, 1, 2, 4, 6, 8, 12, 16, 20,
25, 30, 35, 40, 50, 60, 90, 120, 150, 180, 210, 240,270 e 300 minutos para
obtenção de extrato para análise
Determinação dos componentes fenólicos totais e atividade antioxidante dos
extratos: A determinação do teor de fenólicos totais presentes nas amostras de
extrato foi realizada por meio de espectroscopia na região do visível utilizando
o método de Folin Ciocalteu (FOLIN e CIOCALTEAU, 1927; BOROSKI et al., 2015).
A determinação da atividade antioxidante dos extratos foi realizada utilizando o
método de sequestro de radicais livres (DPPH-2,2-difenil-1-picrilhidrazilo) de
acordo com a metodologia proposta por Gyamfi et al. (1999) e Boroski et al.
(2015).
Determinação de proteínas totais: A determinação do teor de proteínas das folhas
foi realizada pelo método de Kjeldahl de acordo com AOAC (2004).
Resultado e discussão
Cinética da extração: A partir da realização das extrações com etanol
pressurizado, foi possível realizar as curvas cinéticas das extrações, que estão
apresentadas na (Figura 1), de maneira geral, nota-se que ao aumentar a
temperatura de extração para 60°C aumentou-se também o rendimento das extrações,
independente das outras condições (vazão do solvente e pressão) e ao diminuir a
temperatura para 30°C, diminui-se o rendimento das extrações, com exceção da
extração 4 (50 bar, 30°C, 0,5 mL min-1), que difere-se da extração 5
(50 bar, 30°C, 1 mL min-1) apenas pela vazão do solvente.
A temperatura é um parâmetro crítico no processo de extração, pois influencia
diretamente no rendimento e na concentração do extrato. A temperatura altera as
propriedades do solvente e a pressão de vapor do soluto, impactando na
transferência de massa da matéria-prima para o solvente (CHAVES et al., 2022).
Outro ponto é que a temperatura também afeta o processo de separação das
misturas no adsorvente justamente por aumentar a taxa de transferência de massa,
o que causa uma redução na capacidade de retenção do adsorvente (SOUZA et al.,
2020).
Já ao observar a variação da vazão do solvente nas condições de extração,
constata-se que de maneira geral as extrações com vazão do solvente de 0,5 mL
min-1 obtiveram maiores rendimentos de extrato em relação as com
vazão do solvente de 1 mL min-1, quando este era o único fator
variável com exceção das extrações 6 (100 bar, 30°C, 0,5 mL min-1) e
7 (100 bar, 30°C, 1 mL min-1).
Rendimento, Teor de compostos fenólicos, Atividade antioxidante e Teor de
Proteínas: A partir da determinação das curvas cinéticas da extração foi
possível determinar o rendimento total de cada extração, apresentados na Figura
2.
De modo geral supõe-se que há uma influência da vazão de solvente na quantidade
de compostos fenólicos, já que os maiores valores obtidos dentre as extrações
foram aquelas onde a vazão era menor (0,5 mL min-1). Além disso,
observa-se que os maiores teores de fenólicos foram obtidos nas extrações 8 (50
bar, 60°C, 0,5 mL min-1), 6 (100 bar, 30°C, 0,5 mL min-1)
e 10 (100 bar, 60°C, 0,5 mL min-1), que tiveram rendimento de 12, 4,1
e 14,62% respectivamente. Entretanto é relatado que a maior influência na
extração são as temperaturas mais altas que diminuem a viscosidade dos solventes
líquidos, permitindo assim uma melhor penetração das partículas da matriz e
aumentando a extração, além de reduzir a viscosidade, as altas temperaturas
também diminuem a tensão superficial do solvente, dos solutos e da matriz,
permitindo que o solvente “molhe” a matriz da amostra mais completamente (NIETO
et al., 2010).
Apesar de ter obtido um maior rendimento de extrato, a extração 10 apresentou
dentre as três citadas anteriormente a menor quantidade de compostos fenólicos,
possivelmente devido ao fato de sua temperatura (60°C) e pressão (100 bar) serem
maiores que nas outras duas, o que acarretou degradação desses compostos.
Supasatyankul et al., 2022 relata que embora o uso de temperatura elevada
promova maior recuperação de compostos fenólicos, o uso de temperatura de
extração excessiva pode degradar compostos fenólicos.
A partir disso, pode-se dizer que ha um indicativo de que possivelmente pressão,
temperatura e vazão mais baixas favorecem a extração de compostos fenólicos da
folha de ora-pro-nóbis, embora prejudiquem o rendimento total do extrato.
Sumampouw et al., 2021 em (PLE) de compostos fenólicos da alga marrom Fucus
vesiculosus constatou que a elevação da temperatura em alta concentração de
etanol reduzirá o valor de compostos fenólicos.
Cruz et al (2021) identificou em extratos vegetais de OPN uma variação entre 26
e 66 mg EAG g-1, ressaltando que a água é mais eficiente na extração
de fenólicos das folhas, enquanto Garcia et al. (2019) apresenta 23,75 mg EAG
g-1 para extratos hidro alcoólicos.
Quanto a quantidade de proteínas não houve diferença entre as extrações. Já em
relação a atividade antioxidante, a extração 8 também se destacou pois está
entre as com menores valores de IC50, não diferindo
significativamente das outras com menores valores. Lasta et al., 2019 em
extração PLE com resíduos de Beta vulgaris L. constata que o etanol puro
proporciona a seletividade para compostos antioxidantes apresentando atividade
antioxidante elevada quando comparadas com extrações PLE utilizando solvente
hidro alcoólicos.
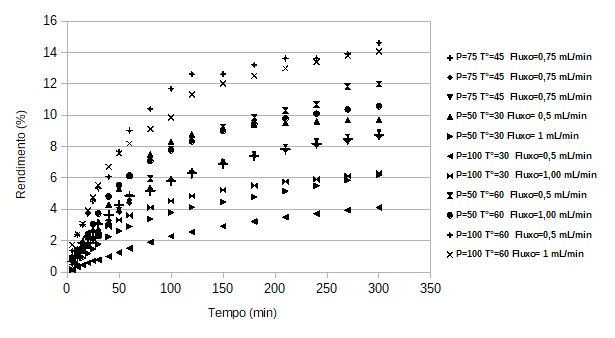
Cinética de extração com etanol pressurizado das folhas de ora-pro-nóbis em diferentes condições de extração (temperatura, pressão e vazão solvente)
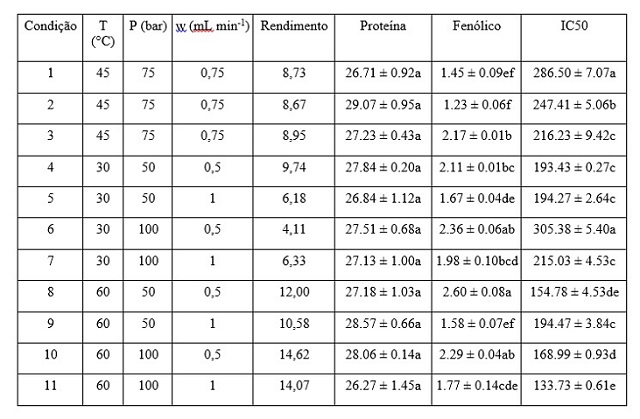
Valores médios (n = 3, ± erro padrão); significancia Tukey (p ≤ 0,05). Teor de Fenólicos (mg EAG/g de extrato). Tempo (T), Pressão (P) e Vazão (w).
Conclusões
Diante do exposto, é possível concluir que a extração 8 (50 bar, 60°C, 0,5 mL min-
1) é a mais adequada, pois fornece um dos maiores rendimentos (12%), utiliza uma
menor quantidade de solvente (0,5 mL min-1) e fornece a maior quantidade de
compostos fenólicos (2,60 mg EAG g-1 de extrato), e obteve bons resultados para
atividade antioxidante (154.78 IC50 µg mL-1) não diferindo significativamente
(p<0,05) em relação as outras condições que também obtiveram bons resultados.
Agradecimentos
Os autores agradecem a UEM, IFPR/Paranavaí e ao CNPq pela concessão de bolsa de
pesquisa.
Referências
ASSOCIATION OF OFICIAL ANALYTICAL CHEMISTRY (AOAC). 2004. Oficial methods of analysis of the AOAC International. 15th ed. Arlington: AOAC.
ALARA, O. R.; ABDURAHMAN, N. H.; UKAEGBU, C. I. Extraction of phenolic compounds: A review. Current Research in Food Science, v. 4, p. 200-214, 2021.
ALVAREZ-RIVERA, G.; BUENO, M.; BALLESTEROS-VIVAS, D.; MENDIOLA, J. A.; IBANEZ, E. Pressurized liquid extraction. In: Liquid-phase extraction. Elsevier, 2020. p. 375-398.
BEMILLER, J. N.; HUBER, K. C. In.: DAMODARAN, S.; PARKIN, K. L.; FENNEMA, O. R. Química de alimentos de Fennema. Porto Alegre: Artmed, 2010, p.75-130
CASTRO-PUYANA, M.; HERRERO, M.; URRETA, I.; MENDIOLA, J. A.; CIFUENTES, A; IBÁÑEZ, E.; SUÁREZ-ALVAREZ, S. Optimization of clean extraction methods to isolate carotenoids from the microalga Neochloris oleoabundans and subsequent chemical characterization using liquid chromatography tandem mass spectrometry. Analytical and bioanalytical chemistry, v. 405, n.13, p. 4607–16, 2013.
CHAVES, J. O.; SANCHES, V. L.; VIGANÓ, J.; DE SOUZA MESQUITA, L. M.; DE SOUZA, M. C.; DA SILVA, L. C.; ROSTAGNO, M. A. Integration of pressurized liquid extraction and in-line solid-phase extraction to simultaneously extract and concentrate phenolic compounds from lemon peel (Citrus limon L.). Food Research International, v. 157, p. 111252, 2022.
CHEMART, F.; KHAN, M. K. Applications of ultrasound in food technology: Processing, preservation and extraction. Ultrasonics Sonochemistry, 2011, v. 18, p. 813-835
CRUZ, T.M.; SANTOS, J.S.; DO CARMO, M.A.V.; HELLSTRÖM, J.; PIHLAVA, J.M.; AZEVEDO, L.; MARQUES, M. B. Extraction optimization of bioactive compounds from ora-pro-nobis (Pereskia aculeata Miller) leaves and their in vitro antioxidant and antihemolytic activities. Food Chemistry, v. 361, p. 130078, 2021.
FARAHNAKY, A.; SHANESAZZADEH, E.; MESBAHI, G.; MAJZOOBI, M. Effect of various salts and pH condition on rheological properties of Salvia macrosiphon hydrocolloid solutions. Journal of Food Engineering, Essex, v. 116, n. 4, p. 782-788, June 2013
GARCIA, J.A; CORRÊA, R.C; BARROS, L; PEREIRA, C; ABREU, R.M; ALVES, M.J; FERREIRA, IC. 2019. Phytochemical profile and biological activities of ‘Ora-pro-nóbis’ leaves (Pereskia aculeata Miller), an underexploited superfood from the Brazilian Atlantic Forest. Food Chemistry, v. 294, p. 302-308, 2019.
HEO, J.-Y.; KIM, S.; KANG, J.-H; MOON, B. Determination of Lutein from Green Tea and Green Tea By-Products Using Accelerated Solvent Extraction and UPLC. Journal of Food Science, v. 79, p. C816 - C821,2014
KIM, S; CHO, A. R.; HAN, J. Antioxidant and antimicrobial activities of leafy green vegetable extracts and their applications to meat product preservation. Food Control,ction, analysis and their antioxidant and anticancer properties. Molecules, v.15, p.7313–7352, 2010. v.29, n.1, p.112-120, 2013.
KOBORI, C. N.; RODRIGUEZ-AMAYA, D. B. Uncultivated Brazilian Green leaves are richer sources of carotenoids than are commercially produced leafy vegetables. Food and Nutrition Bulletin, v.29, n.4, p.320-328, 2008.
LASTA, H. F. B.; LENTZ, L.; RODRIGUES, L. G. G.; MEZZOMO, N.; VITALI, L.; FERREIRA, S. R. S. Pressurized liquid extraction applied for the recovery of phenolic compounds from beetroot waste. Biocatalysis and Agricultural Biotechnology, v. 21, p. 101353, 2019.
LOPEZ-AVILA, V. Sample preparation for Environmental Analysis. Critical Reviews in Analytical Chemistry, v.29, n.3, p.195-230. 1999
NAJI, S.; RAZAVI, S. M. A.; KARAZHIYAN, H. Effect of thermal treatments on functional properties of cress seed (Lepidium sativum) and xanthan gums: a comparative study. Food Hydrocolloids, Oxford, v. 28, n. 1, p. 75-81, July 2012.
NIETO, A.; BORRULL, F.; POCURULL, E.; MARCÉ, R. M. Pressurized liquid extraction: A useful technique to extract pharmaceuticals and personal-care products from sewage sludge. TrAC Trends in Analytical Chemistry, v. 29, n. 7, p. 752-764, 2010.
OLIVEIRA, A. P.; NAOZUKA, J. I. species and proteins distribution in unconventional food plants. Brazilian Journal of Food Technology [online]. 2021, v. 24
SOUZA, M. C.; SANTOS, M. P.; SUMERE, B. R.; SILVA, L. C.; CUNHA, D. T.; MARTINEZ, J.; ROSTAGNO, M. A. Isolation of gallic acid, caffeine and flavonols from black tea by on-line coupling of pressurized liquid extraction with an adsorbent for the production of functional bakery products. Lwt, v. 117, p. 108661, 2020.
SUMAMPOUW, G. A.; JACOBSEN, C.; GETACHEW, A. T. Optimization of phenolic antioxidants extraction from Fucus vesiculosus by pressurized liquid extraction. Journal of Applied Phycology, v. 33, n. 2, p. 1195-1207, 2021.
SUPASATYANKUL, B.; SAISRIYOOT, M.; KLINKESORN, U.; RATTANAPORN, K.; SAE-TAN, S. Extraction of Phenolic and Flavonoid Compounds from Mung Bean (Vigna radiata L.) Seed Coat by Pressurized Liquid Extraction. Molecules, v. 27, n. 7, p. 2085, 2022.
XAVIER, G. B. S. The use of Ora-pró-nobis in nutrition: an integrative review. Brazilian Journal of Development, v. 8, n. 6, p. 45315-45327, 2022.
















