Autores
Oliveira, G. (INSTITUTO SENAI DE INOVAÇÃO EM ENERGIAS RENOVÁVEIS) ; Lobo, C. (INSTITUTO SENAI DE INOVAÇÃO EM ENERGIAS RENOVÁVEIS) ; Carvalho, F. (INSTITUTO SENAI DE INOVAÇÃO EM ENERGIAS RENOVÁVEIS) ; Padilha, C. (UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE) ; Souza, D. (UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE) ; Ruiz, J. (INSTITUTO SENAI DE INOVAÇÃO EM ENERGIAS RENOVÁVEIS)
Resumo
O presente estudo visa aplicar a glicerina no processo de Combustão por Recirculação Química, examinando os efeitos da razão molar Oxigênio-Combustível (ϕ) e da Temperatura do Reator de Redução (TRR) na eficiência de combustão (ηC). Os estudos foram feitos na Unidade de Recirculação Química do Instituto SENAI de Inovação em Energias Renováveis utilizando carga de sólidos (NiO suportado) de aproximadamente 2kg, com taxa de circulação de 12kg/h e vazão de glicerina entre 10,26–33,12 Ln/h no Reator de Redução. Os valores de ϕ e TRR estiveram compreendidos, respectivamente, na faixa de 3–7 e 973–1073K. Ambas as variáveis são relevantes no processo, cujo resultado ótimo foi obtido para ϕ = 7 e TRR = 750°C, com eficiência de combustão igual a 95,44%.
Palavras chaves
Recirculação Química; Glicerina; Captura de CO2
Introdução
O consumo de combustíveis fósseis para fins energéticos ao longo dos dois últimos séculos tem contribuído para o aumento dos danos causados ao meio ambiente pela emissão de gases de efeito estufa (GEE), como o CO2, cuja quantidade de emissões considerando sua geração em indústrias e pela utilização de combustíveis fósseis foi cerca de 38 bilhões de toneladas apenas no ano de 2019, representando um crescimento de 167% em relação ao valor inicial reportado na série histórica, datada de 1990 (BAHRI; VENEZIA; UPADHYAYULA, 2019; CHANG et al., 2021; IPCC, 2022; RAIMUNDO et al., 2018). Para reduzir as emissões de carbono, um dos conceitos mais promissores e passíveis de aplicação é o de Captura, Utilização e Armazenamento de Carbono (do inglês, Carbon Capture, Utilization and Storage – CCUS), que consiste basicamente em separar as correntes de processo que contém CO2 e transportá-las para reservatórios geológicos adequados para o aprisionamento dessa substância ou destiná-las a reutilização em determinados processos químicos ou industriais (D’AMORE; ROMANO; BEZZO, 2021; SHAO et al., 2022). O processo de Combustão por Recirculação Química (CRQ), caracterizado por seu potencial de CCUS, é um método capaz de gerar energia com potencial para a captura de CO2. Nele, são utilizados Transportadores Sólidos de Oxigênio (TSOs), geralmente constituídos de um óxido metálico cujo intuito é transferir o oxigênio do ar para o combustível, evitando o contato direto entre esses dois reagentes, assim como transportar energia na forma de calor produzido durante a oxidação do metal. As reações acontecem em dois reatores: Reator de Oxidação (RO) e Reator de Redução (RR). O combustível injetado no RR reage com o TSO, proporcionando a combustão completa e liberando CO2 e H2O, sendo o óxido reduzido à sua forma metálica. O transportador de oxigênio, por sua vez, é transferido ao Reator de Oxidação e reage com o ar, voltando à forma de óxido e permitindo que um novo ciclo de reações de redução e oxidação seja realizado. A principal vantagem desse processo é a facilidade de obtenção de uma corrente praticamente pura de CO2 sendo liberada do RR, uma vez que a água produzida na reação pode ser facilmente condensada e não há presença de N2 na corrente que contém CO2, diferentemente do que ocorre no processo de combustão convencional (GARCÍA-LABIANO et al., 2004; LYNGFELT; THUNMAN, 2005). Além disso, uma vez que o ar não entra em contato direto com o combustível, a liberação dos óxidos de nitrogênio provenientes da combustão é minimizada e, consequentemente, os danos ambientais do processo de combustão são mitigados (ALALWAN; ALMINSHID, 2021). Nos últimos 3 anos, o interesse nos processos de Recirculação Química segue em ascensão, sendo a China o protagonista de pesquisas referentes à área. Por outro lado, o Brasil tem apresentado, pontualmente, estudos relevantes no tema, de modo que a nacionalização desse conhecimento pode ser um fator impactante para o país no que diz respeito aos processos de Recirculação Química e, assim, alavancar ainda mais a posição de produção de energia com uma matriz energética de baixas emissões de GEE. Dentre as técnicas de produção de biodiesel, a mais utilizada industrialmente é a reação de transesterificação. Estima-se que 10% dos produtos gerados nessa reação sejam de glicerina bruta (crude glycerol), caracterizando-o como o principal subproduto da indústria do biodiesel. Apenas em 2020, foram produzidas mais de 700 quilotoneladas desse subproduto (AGÊNCIA NACIONAL DO PETRÓLEO, 2021), de tal forma que o aproveitamento dessa substância como matéria-prima para outros processos industriais vem sendo estudada por pesquisadores ao redor do mundo. Devido a sua elevada entalpia de combustão, que ultrapassa os 1600 kJ.mol-1 (BASTOS et al., 1988), esse resíduo possui grande potencial energético, sobretudo nos processos químicos, favorecendo a geração de gases em alta temperatura a serem utilizados em trocadores de calor, caldeiras e outros. Assim, o objetivo deste estudo é avaliar, através do monitoramento da eficiência de combustão, a viabilidade de aplicação da glicerina com teor de umidade no processo de Combustão por Recirculação Química, examinando os efeitos referentes a razão molar Oxigênio-Combustível (ϕ) e a Temperatura do Reator de Redução (TRR).
Material e métodos
A glicerina foi adquirida na Cromoline – Química Fina, com pureza de 99,5%, utilizando água destilada para diluição a fim de obter solução com 87,2% (%m/m) de glicerina e o TSO a base de níquel suportado em α-alumina, com fase ativa de 18% de óxido de níquel (18%NiO/α-Al2O3), foi fabricado pelo Instituto de Carboquimica – Consejo Superior de Investigaciones Cientificas (ICB-CSIC), que detém a patente. As características do Transportador Sólido de Oxigênio utilizado no presente estudo podem ser encontrados no estudo de ADÁNEZ ET AL. (2009). Além desses, também foram utilizados os gases N2 (padrão comercial) e CO2 (alta pureza) fornecidos pela White Martins. Os experimentos foram conduzidos na Unidade Experimental de Recirculação Química (URQ) do Instituto SENAI de Inovação em Energias Renováveis (ISI-ER/RN), com capacidade para 1kWth. Inicialmente, foi conferida a fluidização e circulação do TSO no sistema para que a circulação de sólidos fosse avaliada a fim de garantir os tempos de residência necessários. Após essa etapa, a distribuição de gases pelo Loop Seal entre os reatores foi aferida a fim de impedir a mistura das correntes gasosas produzidas em cada uma das reações. Por fim, a glicerina foi injetada no Reator de Redução (RR), permitindo o início da reação. A regeneração do TSO no Reator de Oxidação (RO) foi realizada considerando a reação de 2 mols de níquel metálico (Ni) com 1 mol de oxigênio (O2), gerando 2 mols de óxido de níquel (NiO). A Temperatura do Reator de Redução (TRR) foi estudada nos níveis 973K, 1023K e 1073K e a vazão volumétrica de glicerina (Q̇Comb,RR) esteve na faixa entre 10,26–33,12Ln/h para fornecer os valores de ϕ correspondidos entre a faixa de 3 a 7. A carga de sólidos para realização dos experimentos foi de 2kg, com taxa de circulação de sólidos (ṁs) de aproximadamente 12 kg/h, e as vazões totais do Reator de Redução (Q̇RR) e de Oxidação (Q̇RO) foram, respectivamente, de 150 e 1100Ln/h. Os analisadores utilizados foram o SIEMENS/CALOMAT 6 (H2) e SIEMENS/CALOMAT 23 (CO, CO2, CH4 e O2). O tratamento de dados foi realizado com os softwares Microsoft Excel® (v. 2016), Origin® Pro 2016 e StatSoft Statistica® (v.7). O cálculo da razão molar oxigênio-combustível (ϕ) é realizado considerando a razão entre a taxa de circulação de óxido de níquel e o produto entre a quantidade de glicerina alimentada no sistema e o coeficiente estequiométrico da reação de combustão da glicerina com o NiO.
Resultado e discussão
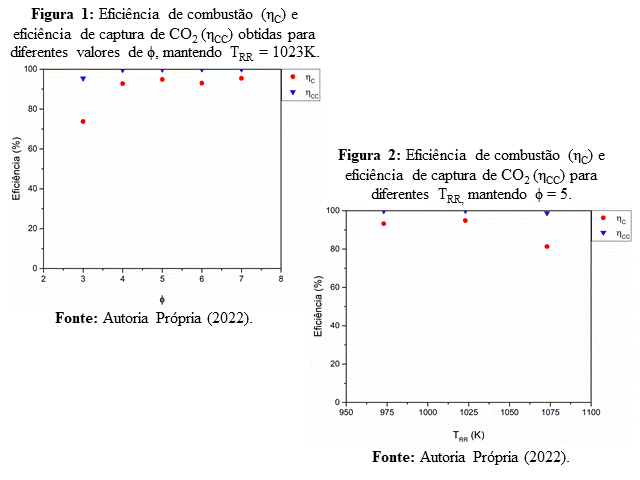
As Figuras 1 e 2 reportam as eficiências obtidas durante a realização do estudo para a glicerina pura, cujas análises foram realizadas com base em cada efeito individualmente e na interação entre os dois efeitos. Para as análises de cada efeito realizadas individualmente, foi considerada a modificação de uma variável enquanto a outra foi mantida constante. Além disso, as reações cujas influências foram discutidas para o processo em questão encontram-se na Tabela 1. A eficiência de combustão (ηC) foi calculada considerando a razão entre o somatório do oxigênio necessário para queimar cada uma das substâncias residuais da combustão da glicerina (C3H8O3, CH4, CO, H2) e o oxigênio necessário para combustão completa da glicerina, em ambos os casos considerando reações estequiométricas com NiO. Uma vez calculado esse valor em percentual, ele foi subtraído de 100% para fornecer o valor da eficiência de combustão. A eficiência de captura de CO2 (ηCC), por sua vez, leva em consideração a razão percentual entre o balanço de carbono dos gases de saída do RR e a soma do balanço de carbono dos gases de saída do RR e do RO. Se nenhum gás à base de carbono é liberado no RO, a eficiência de captura será de 100%. 1.1.1 Efeito da razão molar oxigênio-combustível (ϕ): Uma das principais variáveis no processo de Combustão por Recirculação Química é a razão molar oxigênio-combustível, uma vez que é necessário que o oxigênio esteja em excesso no meio para que a combustão completa aconteça. Uma razão igual a 1 indica que todo o oxigênio fornecido para a reação corresponde à quantidade estequiométrica necessária para que a combustão completa aconteça, mas relatos na literatura indicam que é necessário ao menos 25% de oxigênio em excesso para que essa reação seja predominante (ADÁNEZ-RUBIO et al., 2021). Nesse sentido, a variável foi modificada na faixa de 3 até 7, de modo a garantir o excesso de oxigênio. De acordo com a Figura 1, mesmo utilizando um valor de ϕ = 7 (cerca de 560% maior que o excesso recomendado pela literatura), não foi possível atingir uma eficiência de combustão (ηC) de 100% (combustão completa), apesar da glicerina ter sido completamente convertida. À medida que mais oxigênio é disponibilizado no meio, maior é a quantidade de CO2 gerada na corrente de produtos do processo. Isso acontece pelo fato que todos os experimentos foram realizados com valores de ϕ superiores 1, o que teoricamente favorece a ocorrência da combustão completa. Dessa forma, quanto mais oxigênio é disponibilizado ao meio reacional, menor a tendência de ocorrência de reações indesejadas (reforma e oxidação parcial, por exemplo) e, consequentemente, menor a quantidade de gases oriundos dessas reações. Apesar do excesso de oxigênio, a combustão completa não foi alcançada para os valores de ϕ empregados no estudo, contrariando o comportamento esperado por ADÁNEZ-RUBIO ET AL. (2021), sob a justificativa da presença de reações paralelas (R.2 – R.11) envolvidas no processo. Para a eficiência de captura (ηCC), por sua vez, os valores estiveram sempre superiores a 99,5%, exceto para ϕ = 3, cujo valor atingido foi em torno de 95%. Esse fato pode ser explicado com base na circulação de sólidos entre os reatores, indicando que baixos valores de ϕ precisam de menor tempo de residência a fim de evitar a deposição de coque (R.7) na superfície do TSO, carbono esse que será liberado no RO após contato com o ar pela reação entre 1 mol de carbono (C) e 1 mol de oxigênio (O2), liberando 1 mol de dióxido de carbono (CO2). Assim, para a faixa da variável estudada, a condição de ϕ = 7 apresentou os melhores resultados. 1.1.2 Efeito da Temperatura do Reator de Redução (TRR): A TRR também desempenha papel importante nas reações químicas que acontecem no processo, visto que essa é uma das variáveis responsáveis por fornecer a energia requerida para ocorrência das reações químicas. Os resultados experimentais indicaram que o aumento de TRR após 1023K favoreceu a formação de H2 e CO e, consequentemente, reduziu a eficiência de combustão (ηC), visto que essa é uma variável dependente da composição dos produtos residuais da combustão da glicerina. O aumento de H2 pode ser explicado pela oxidação do TSO por vapor d’água (R.11) ou pela gaseificação de carbono depositado na superfície do sólido (R.8) no RR, consumindo o vapor de água alimentado no sistema, enquanto que a diminuição do CO2 pode ser explicada pela gaseificação do carbono com CO2 (R.9), aumentando também a produção de CO. A Figura 2 ilustra esse comportamento, sendo esse efeito associado à energia requerida para as reações paralelas (a gaseificação do carbono e oxidação do Ni no RR, por exemplo), visto que o aumento de temperatura favorece essas reações em detrimento da combustão. Tal fenômeno contraria aquele observado por ABAD ET AL. (2009), DE DIEGO ET AL. (2016) e FIGUEREDO ET AL. (2019), que reportaram melhorias no processo de combustão com o aumento de TRR. A explicação reside no fato que os combustíveis utilizados pelos autores eram puros ou, no máximo, misturas combustíveis (misturas de H2 e CH4, por exemplo), não contendo nenhuma impureza capaz de proporcionar reações indesejadas, como é o caso da água presente na glicerina. 1.1.3 Interação entre ϕ e TRR: A interação entre as duas variáveis também foi estudada estatisticamente, de modo que o ponto ótimo foi obtido entre TRR ≈ 1000–1025K e ϕ ≈ 5–7. A eficiência de combustão tende a ser prejudicada com aumentos de temperatura e reduções da razão molar oxigênio-combustível. Conforme análise realizada, a 95% de confiança, ambas as variáveis possuem efeitos estatisticamente significativos, com a variável ϕ influenciando de forma positiva a eficiência de combustão, enquanto aumentos em TRR tendenciam a reduzir a eficiência do processo.

Conclusões
No presente estudo, a combustão da glicerina com teor de umidade foi avaliada de forma experimental. As variáveis observadas foram a razão molar oxigênio-combustível e a temperatura do reator de redução. A análise dos resultados obtidos para cada variável individualmente permitiu concluir que, quanto mais oxigênio disponível no meio, mais favorecido será o processo de combustão. Por outro lado, à medida que a razão molar é reduzida, o surgimento de reações paralelas que favorecem a produção de gás de síntese se torna mais preponderante, impactando negativamente na eficiência de combustão. A temperatura também possui efeito fundamental no processo visto que, contrapondo o que foi reportado na literatura, aumentos nessa variável desfavoreceram o processo de combustão devido à presença de impureza (água) na glicerina. Os impactos das duas variáveis foram analisados, também, de forma simultânea, corroborando o comportamento encontrado para os efeitos individuais. Nesse sentido, a condição ótima encontrada foi para a razão molar oxigênio-combustível igual a 7 e temperatura do reator de redução de 1023K (750°C), cuja eficiência de combustão atingida foi de 95,44% e eficiência de captura de carbono de 100%.
Agradecimentos
Referências
ABAD, A. et al. Modeling of the chemical-looping combustion of methane using a Cu-based oxygen carrier. Energy Procedia, v. 1, n. 1, p. 391–398, fev. 2009.
ADÁNEZ-RUBIO, I. et al. Use of bio-glycerol for the production of synthesis gas by chemical looping reforming. Fuel, v. 288, p. 119578, mar. 2021.
AGÊNCIA NACIONAL DO PETRÓLEO, G. N. E B. Anuário Estatístico Brasileiro do Petróleo, Gás Natural e Biocombustíveis. Rio de Janeiro: [s.n.]. Disponível em: <https://www.gov.br/anp/pt-br/centrais-de-conteudo/publicacoes/anuario-estatistico/anuario-estatistico-2021>.
ALALWAN, H. A.; ALMINSHID, A. H. CO2 capturing methods: Chemical looping combustion (CLC) as a promising technique. Science of The Total Environment, v. 788, p. 147850, set. 2021.
BAHRI, S.; VENEZIA, A. M.; UPADHYAYULA, S. Utilization of greenhouse gas carbon dioxide for cleaner Fischer-Tropsch diesel production. Journal of Cleaner Production, v. 228, p. 1013–1024, ago. 2019.
BASTOS, M. et al. Thermodynamic properties of glycerol enthalpies of combustion and vaporization and the heat capacity at 298.15 K. Enthalpies of solution in water at 288.15, 298.15, and 308.15 K. The Journal of Chemical Thermodynamics, v. 20, n. 11, p. 1353–1359, nov. 1988.
CHANG, Y.-Z. et al. Adsorption of greenhouse gases (methane and carbon dioxide) on the pure and Pd-adsorbed stanene nanosheets: A theoretical study. Surfaces and Interfaces, v. 22, p. 100878, fev. 2021.
D’AMORE, F.; ROMANO, M. C.; BEZZO, F. Carbon capture and storage from energy and industrial emission sources: A Europe-wide supply chain optimisation. Journal of Cleaner Production, v. 290, p. 125202, mar. 2021.
DE DIEGO, L. F. et al. Bioethanol combustion with CO2 capture in a 1kWth Chemical Looping Combustion prototype: Suitability of the oxygen carrier. Chemical Engineering Journal, v. 283, p. 1405–1413, jan. 2016.
FIGUEREDO, A. L. Determinação da reatividade e análise termodinâmica de Transportadores Sólidos de Oxigênio para Recirculação Química. [s.l.] (Dissertação de Mestrado em Engenharia Química), Universidade Federal do Rio Grande do Norte, 2016.
GARCÍA-LABIANO, F. et al. Reduction and Oxidation Kinetics of a Copper-Based Oxygen Carrier Prepared by Impregnation for Chemical-Looping Combustion. Industrial and Engineering Chemistry Research, v. 43, n. 26, p. 8168–8177, 1 dez. 2004.
IPCC. Climate Change 2022: Mitigation of Climate Change. [s.l: s.n.].
LYNGFELT, A.; THUNMAN, H. Construction and 100 h of Operational Experience of A 10-kW Chemical-Looping Combustor. In: Carbon Dioxide Capture for Storage in Deep Geologic Formations. [s.l.] Elsevier, 2005. p. 625–645.
RAIMUNDO, D. R. et al. Evaluation of greenhouse gas emissions avoided by wind generation in the Brazilian energetic matrix: A retroactive analysis and future potential. Resources, Conservation and Recycling, v. 137, p. 270–280, out. 2018.
SHAO, B. et al. CO2 capture and in-situ conversion: recent progresses and perspectives. Green Chemical Engineering, v. 3, n. 3, p. 189–198, 2022.
















