Autores
Sousa, E.J.R. (INSTITUTO FEDERAL DO CEARÁ, CAMPUS MARACANAÚ) ; Oliveira, M.M.R. (INSTITUTO FEDERAL DO CEARÁ, CAMPUS MARACANAÚ) ; Teixeira, J.P.O. (INSTITUTO FEDERAL DO CEARÁ, CAMPUS MARACANAÚ) ; Ribeiro, J.A.S. (INSTITUTO FEDERAL DO CEARÁ, CAMPUS FORTALEZA) ; Freitas, C.R. (INSTITUTO FEDERAL DO CEARÁ, CAMPUS MARACANAÚ) ; Araujo, R.S. (INSTITUTO FEDERAL DO CEARÁ, CAMPUS FORTALEZA) ; Salgado, B.C.B. (INSTITUTO FEDERAL DO CEARÁ, CAMPUS MARACANAÚ)
Resumo
O aumento da demanda energética mundial durante as próximas décadas tem pressionado o desenvolvimento de outras fontes de energia. O H2 é um destaque frente à essa crescente demanda. O desenvolvimento de rotas alternativas de síntese é essencial a uma nova economia a base de H2 e nesse contexto a fotocatálise é importante. Este trabalho tem por objetivo avaliar um sistema de produção de H2 sob uma metodologia de otimização utilizando catalisadores bimetálicos. O planejamento avaliou o efeito das variáveis: % Cu, concentração de glicerina e pH inicial sobre o volume e taxa de evolução de H2. Resultados de otimização promissores foram obtidos com o catalisador Cu0,6/Ni0,4; em pH = 7,0 e 15,54% de glicerina, com volume produzido de H2 de 10,67 mL e taxa de evolução de 5.795,9 μmol/g.h
Palavras chaves
Hidrogênio; fotocatálise; otimização
Introdução
É esperado o aumento da demanda energética mundial em 35% durante os próximos 20 anos, decorrente do crescimento econômico dos países em desenvolvimento. O iminente esgotamento dos combustíveis fósseis e as crescentes exigências por políticas voltadas à sustentabilidade têm incentivado a maior oferta de fontes renováveis de energia mais eficientes para suplementar tais demandas (CHAUDRY; BAHRI; MOHEIMANJI, 2015; JOHSON; KJARSTAD, ROOTZÉN, 2019). O H2 é uma das principais alternativas complementares aos derivados do petróleo, com capacidade de servir aos setores industrial, de transporte e para abastecimento doméstico. O H2 como fonte de energia não produz CO2 após combustão, o principal gás de efeito estufa (SANTOS, et al., 2020). Cerca de 120 Mt de H2 são produzidos anualmente, o que equivale a cerca de 14,4 EJ ou 4000TWh, das quais cerca de 95% são produzidos a partir do gás natural e carvão. Hidrogênio é um combustível cuja relação custo-eficiência tem potencial de beneficiar a economia dadas suas características físico-químicas que o tornariam competitivo frente a outras fontes energéticas (KAKOULAKI, et al.,2021; ABE, et al., 2019).O uso extensivo do H2 atualmente enfrenta dificuldades pela disparidade de seu preço quando comparado às matrizes energéticas tipicamente empregadas, o que o torna menos competitivo principalmente pela ausência de tecnologias compatíveis. Schenckery et al. (2020) traçaram um plano cujas políticas de incentivos tornam o H2 rentável, o qual se baseia no desenvolvimento de um eixo tecnológico baseado na certificação da redução da emissão de CO2 por um equivalente de H2 produzido e a redução dos riscos de investimentos por implementação tecnológica a base de hidrogênio. Como principal fonte de H2, a reforma de CH4 é responsável pela emissão anual de até 830 milhões de toneladas de CO2 e CO. Atualmente, a principal tecnologia limpa empregada para produção de H2 envolve a eletrólise com fontes solar e eólica, e de maneira complementar, a produção de H2 por fotocatalisadores é uma alternativa renovável e promissora (SERPONE, 2000; AMETA, 2018).Quando irradiados por fótons de energia adequada, os fotocatalisadores assumem estado de excitação, podendo realizar reações catalíticas. O ganho de energia promovido pela luz gera o deslocamento do elétron excitado (e-) para a banda de condução (CB), deixando uma lacuna (h+) na banda de valência (VB), formando sítios de redução e oxidação, respectivamente (Fig. 1). Grande parte dos pares e-/h+ irão se recombinar, no entanto, uma migração superficial poderá iniciar uma série de reações com as espécies químicas adsorvidas sobre o catalisador (ACAR; DINCER; ZAMFIRESCU, 2014; FAJRINA; TAHIR, 2019).O TiO2 é um material promissor para aplicação em estudos fotocatalíticos de evolução de H2, no entanto a elevada band-gap (3,2 eV) limita a separação de H2O sob luz visível. Reações não espontâneas como a redução de CO2 e a evolução de H2 tendem a gerar acúmulo de cargas sobre a superfície de fotocatalisadores, o que acelera a recombinação dos pares. Modificações sobre a estrutura de TiO2 possibilitam melhor desempenho do sólido, como o controle de morfologia, modificação superficial, heterojunção, dopagem e deposição de cocatalisador (LIU et al., 2022; TAHIR, 2019; ZHONG, et al., 2021). Alguns metais nobres ou óxidos metálicos, como: Pt, Pd, Au e Ag, RuOx e IrOx apresentam excelente atividade fotocatalítica para evolução de H2, no entanto a escassez e custo são obstáculos para aplicações em larga escala e, portanto, o uso de metais menos nobres é recomendado (LIAO, et al., 2012; BAI, et al., 2014).Metais atuantes como cocatalisadores aumentam o tempo de separação entre os pares eletrônicos gerados sobre a superfície de TiO2, gerados a partir das mudanças na estrutura eletrônica do semicondutor. O efeito sinérgico da combinação de metais decorrente de diferentes sítios ativos em ligas metálicas geralmente apresenta características eletrônicas, ópticas e fotocatalíticas superiores àquelas verificadas em partículas monometálicas (XIAO et al, 2019).Han et al. (2021) avaliaram o efeito das ligas bimetálicas de Ru e Ni sobre g-C3N4 na produção de H2. Os resultados mostraram aumento da atividade de g-C3N4, que na forma pura apresentou taxa de geração de H2 de 310 μmol.g-1.h-1. Em contrapartida, a combinação de Ru e Ni eficientemente produziram cerca de 35.100 μmol.g-1.h-1 de H2. Os resultados dos materiais bimetálicos se mostraram superiores à atividade dos monometálicos, correspondentes a 230 μmol H2.g-1.h-1 para o Ni e 10.960 μmol H2.g-1.h-1 para o Ru. Neste contexto, o presente trabalho tem por objetivo avaliar o potencial de cocatalisadores bimetálicos a base de Cu e Ni em reações fotocatalíticas para produção de H2.
Material e métodos
Reagentes Álcool metílico e glicerina foram fornecidos pela Êxodo Científica. Cu(NO3).3H2O foi adquirido da Dinâmica e Ni(NO3).6H2O foi fornecido pela Alphatec, ambos sem qualquer processo adicional de purificação. H2SO4 e NaOH foram adquiridos da Dinâmica, também sem qualquer processo adicional de purificação. O TiO2 P25 utilizado foi fornecido pela Evonik®. Síntese dos catalisadores A dopagem bimetálica foi realizada por fotodeposição em sistema de múltiplas reações simultâneas (M.R.S) sob patente BR 1020210170980 (Figura 2). Para a síntese, aproximadamente 500 mg de TiO2 foram misturados a 25 mL de metanol e volumes adequados das soluções estoques de Cu e Ni (ambas 0,1 M). O percentual de metal total foi mantido em 1% com razão variável de Cu e Ni. A mistura foi mantida sob agitação a 160 rpm por 2 h, seguida de irradiação por lâmpada xênon (300 W) por 3 h. O sólido resultante foi submetido a lavagem e separado por centrifugação e finalmente seco em estufa a 80°C por 24 h. O material obtido foi denominado TiO2 – Cux1.Ni(1-x1), onde x1 e (1-x1) são os percentuais de Cu e Ni em relação ao total de dopante (1,0%), respectivamente. Produção fotocatalítica de H2 Para os estudos de otimização do sistema foi empregado um planejamento fatorial do tipo estrela de três partes: fatorial, axial e pontos centrais. As variáveis empregadas estão destacadas na Tabela 1. O volume de H2 produzido (mL) e a taxa de evolução de H2 (H2 Evolution Rate, HER, μmol.g-1.h-1) foram definidos como respostas experimentais de interesse. Os ensaios catalíticos foram realizados em duplicata e estão descritos na Tabela 2.As reações foram conduzidas por 3 h em reator M.R.S usando vials com soluções de glicerina e catalisador (1,0 g.L-1 ) para um volume reacional de 25 mL. A temperatura de reação foi mantida constante em 35°C ± 2°C com auxílio de um ventilador cooler. O pH das soluções foi ajustado com emprego de soluções aquosas 0,01 M de H2SO4 ou NaOH. Análise do H2 produzido O H2 foi quantificado utilizando um cromatógrafo gasoso (Trace 1310, da Thermo) equipado com coluna Carboxen 1010 PLOT e detector de condutividade térmica (TCD). O tempo de corrida foi mantido em 6 min com fluxo constante de gás de arraste de N2 a 20,0 mL.min-1, fluxo do gás de referência de 1,0 mL.min-1 e polaridade negativa. A temperatura do injetor foi mantida em 200°C e a temperatura do forno em 50°C. O detector foi mantido com temperatura de 230°C e o filamento a 380°C.
Resultado e discussão
A Tabela 2 destaca a matriz de experimentos e os resultados de evolução de H2 e sua taxa de evolução (HER, μmol.g-1.h-1) para catalisadores os bimetálicos TiO2 – Cux1.Ni(1-x1)empregados.A priori, os experimentos fotocatalíticos realizados confirmam que o método de síntese utilizado se mostrou eficiente para a evolução de H2, haja vista a atividade fotocatalítica superior em relação ao TiO2 puro (< 1,0 mL) nas mesmas condições experimentais. Em relação a razão Cu/Ni, os testes 1 e 2 mostram que o aumento do percentual de Cu, de 20 para 80%, em relação ao total de metais desempenha efeito positivo para a produção de H2, com incremento de 6,22 para 10,18 mL e elevação da taxa de evolução de H2 em 66,3%. No entanto, sob 80% de Cu, pode ser observado que o aumento do pH do meio reacional (de 5,0 a 9,0) reduz significativamente a eficiência de geração de H2, como indicado nos experimentos 2 e 4. Preliminarmente, pode-se assumir que a relação pH e proporção % de Cu, quando aumentadas simultaneamente, afetam negativamente a produção de H2. Com o aumento de pH, a diferença dos potenciais de oxidação – redução de H+/H2 e o nível de Fermi nos sítios Cu/Ni tende contra a evolução de H2 (Tian et al., 2015). Empregando Ni a 80% (experimentos 1 e 3), observa-se que mesmo que o pH seja aumentado de 5,0 a 9,0, o efeito é pouco significativo para a evolução de H2, ocorre apenas um leve aumento da produção de H2 de 6,22 para 6,50 mL com a taxa de evolução de gás incrementada de 3.338,8 para 3.502,9 μmol.g-1.h-1 (4,9%). Os resultados demonstram que um maior conteúdo de Ni garante maior estabilidade do potencial de oxidação/redução do catalisador no intervalo observado (5,0 a 9,0) para a evolução de H2 (ZHANG, et al., 2019). A análise de variância (ANOVA) para a otimização da evolução de H2 está apresentada na Tabela 3 (fatores significativos em negrito). Os resultados encontrados indicam que o modelo gerado é eficiente para descrever a produção fotocatalítica de H2. O valor de R2 de 0,8932 é elevado para este tipo de aplicação (KADIER et al., 2022), sendo capaz de explicar 89% da variabilidade para a produção de H2. A qualidade do ajuste do modelo também é validada pelo valor de R2Ajustado (> 0,70), o que indica a adequação dos fatores significativos ao modelo obtido e explica cerca de 73% da variabilidade observada na produção de H2. O teste F para a regressão dos dados mostra valores de p inferiores a 0,05 para a dosagem de Cu e pH (quadrático), indicando significância satisfatória para os níveis dos fatores escolhidos (Chen et al., 2014). A Figura 3 apresenta o gráfico de Pareto do planejamento fatorial, incluindo os fatores significativos do modelo para a evolução de H2, bem como o efeito padrão de cada fator e suas interações. Os fatores x1, x12 e x22 apresentam as maiores contribuições (17,71%, 16,18% e 28,09%), respondendo por aproximadamente 62% sobre a resposta experimental. Como esperado, o incremento da proporção % de Cu apresenta uma contribuição positiva entre os efeitos, indicando que o aumento de x1 em 0,3% em relação ao total de dopante contribui em 17,71% sobre o total de H2 produzido. Em contrapartida para as variáveis quadráticas x1 e x2, são observadas significâncias negativas para a evolução de H2. Os valores indicam que o aumento nas variáveis x1 e x2 acima de um valor ideal reduzem a evolução de H2 de 16,18 e 28,09%, respectivamente, conforme pode ser visto na Figura 3. A partir do modelo de regressão otimizado, a evolução de H2 pode ser descrita com nível de confiabilidade de 95% pela Equação 1, onde 9,40642 é o intercepto, x1 é o percentual de Cu em relação ao total de dopante e x2 é o pH inicial. A Figura 4 mostra que os dados previstos estão em concordância com os valores experimentais (R2 = 0,8856). Quando comparado ao R2Ajustado, a diferença apresentada é inferior a 0,2 indicando boa adequação do modelo (KUMAR et al.,2016). Assim, a equação de regressão pode ser usada para prever satisfatoriamente evolução de H2 a partir das condições experimentais utilizadas. A superfície de resposta para a produção de H2 sobre os catalisadores bimetálico usando a glicerina como substrato está apresentada na Figura 5. A Figura 5 mostra que sob baixo conteúdo de Cu (0,2%) e alto percentual de Ni (0,8%) a produção de H2 é limitada a um volume inferior a 7,0 mL quando a reação ocorre em meio ácido (5,0 a 6,6). Volumes de H2 superiores a 9,0 mL são alcançados nos intervalos de Cu de 0,56 a 0,68 % para valores de pH inicial entre 6,6 e 7,0 o que indica o efeito sinérgico das composições de Cu e Ni nas condições reacionais empregadas (SPANU et al., 2018). O desempenho dos catalisadores nas condições otimizadas do sistema pode ser verificado a partir dos resultados dos pontos críticos destacados na Tabela 4. Os dados obtidos neste trabalho sugerem que a metodologia adotada é eficiente para a produção de H2 e resultados promissores quando comparados a outros trabalhos da literatura. Sawar, Tahir e Alias (2022) utilizaram g-C3N4 dopado com ligas bimetálicas de Ni – Ag e obtiveram uma taxa máxima de evolução de H2 de 2.137,5 μmol.g-1.h-1. Li et al. (2020) avaliaram o ZnCdS modificado com ligas de Ni – Co e obtiveram cerca de 3.500 μmol.g-1.h-1. Ambos os trabalhos apresentaram taxas de evolução de hidrogênio inferior ao reportado no presente estudo.
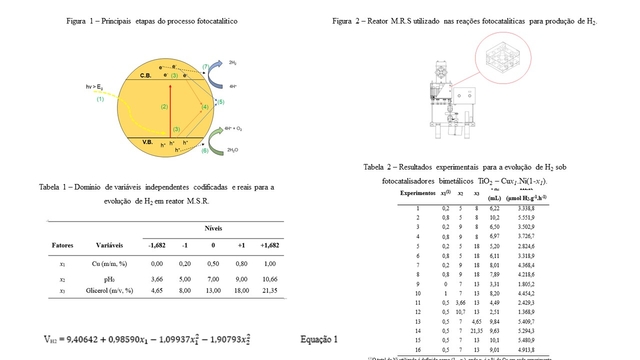
Figura 1, Figura 2, Tabela 1 , Tabela 2, Equação 1.
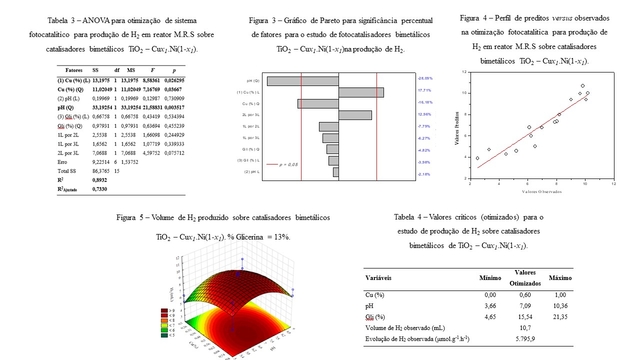
Tabela 3, Figura 3, Figura 4, Figura 5, Tabela 4.
Conclusões
A escolha das condições experimentais se mostrou eficiente para a elaboração de um modelo matemático capaz de descrever o sistema fotocatalítico, apresentando ajuste dos experimentos superiores a 89%. A metodologia de síntese também pode ser considerada eficiente, como verificado a partir do aumento significativo da atividade de TiO2 quando dopado com Cu e Ni. Os resultados de produção de H2 para os catalisadores bimetálicos são promissores e demonstram que há grande potencial para o aperfeiçoamento e desenvolvimento de novas pesquisas de componentes bimetálicos para evolução fotocatalítica de hidrogênio.
Agradecimentos
Os autores agradecem o apoio financeiro da Fundação Cearense de Apoio Científico e Tecnológico (FUNCAP) por meio do projeto Produção Sustentável de Hidrogênio Verde a partir de resíduo de biomassa e radiação solar,Edital Nº 6/2020
Referências
ABE, J. O.; POPOOLA, A. P. I.; AJENIFUJA, E.; POPOOLA, O. M. Hydrogen energy, economy, and storage: Review and recommendation. International Journal of Hydrogen Energy, v. 44, p. 15072 – 15086, 2019. ACAR, C., DINCER, I., ZAMFIRESCU, C. A review on selected heterogeneous photocatalysts for hydrogen production. International Journal of Energy Research, v. 38, p. 1903 – 1920, 2014. AMETA, R.; SOLANKI, M. S.; BENJAMIN, S.; AMETA, S. C. Photocatalysis, Advance Academic Press, v. 1, p. 135 – 175, 2018. BAI, X.; ZONG, R.; LI, C.; LIU, D.; LIU, Y.; ZHU, Y. Enhanced of visible photocatalytic activity via Ag@C3N4 core-shell plasmonic composite. Applied Catalysis B: Environmental, v. 147, p. 82 – 91, 2014. CHAUDRY, S.; BAHRI, P. A.; MOHEIMANJI, N. R. Pathways of processing of wet microalgae for liquid fuel production: A critical review. Renewable and Sustainable Energy Reviews, v. 52, p. 1240 – 1250, 2015. CHEN, K.; WANG, G. H.; LI, W. B.; WAN, D.; HU, Q.; LU, L. L. Application of response surface methodology for optimization of Orange II removal by heterogeneous Fenton-like process using Fe3O4 nanoparticles. Chinese Chemical Letters, v. 25, p. 1455 – 1460, 2014. FAJRINA, N., TAHIR, M. A critical review in strategies to improve photocatalytic water splitting towards hydrogen production. International Journal of Hydrogen Energy, v. 44, p. 540 – 577, 2019. HAN, X.; SI, T.; LIU, Q.; ZHU, F.; LI, R.; CHEN, X.; LIU, J.; SUN, H.; ZHAO, J.; LING, H.; ZHANG, Q.; WANG, H. 2D bimetallic RuNi alloy Co-catalysts remarkably enhanced the photocatalytic H2 evolution performance of g-C3N4 nanosheets. Chemical Engineeering Journal, v. 15, p. 130824, 2021. JOHNSON, F., KJARSTAD, J., ROOTZÉN, J. The treat to climate change mitigation posed by the abundance of fossil fuels. Climate Policy, v. 19, p. 258 – 274, 2019. KADIER, A., WANG, J., CHANDRASEKHAR, K., ABDESHAHIAN, P., ISLAM, M. A., GHANBARI, F., BAJPAI, M., KATOCH, S. S., BHAGAWATI, P. B., LI, H., KALIL, M. S., HAMID, A. A., HASAN. H. A., MA, P. C. Performance optimization of microbial electrolysis cell (MEC) for pal oil mill effluent (POME) wastewater treatment and sustainable Bio-H2 production using response surface methodology (RSM). International Journal of Hydrogen Energy, v. 47, p. 15464 – 15479, 2022. KAKOULAKI, G., KOUGIAS, I.; TAYLOR, N.; DOLCI, F.; MOYA, J.; JAGER-WALDAU, A. Green hydrogen in Europe – A regional assessment: Substituting existing production with electrolysis powered by renewables. Energy Conversion and Management, v. 228, p. 113649, 2021. KUMAR, B. R.; SARAVANAN, S.; RANA, D.; NAGENDRAM, A. Combined efect of injection timind and exhaust gas recirculation (EGR) on performance and emissions of a DI diesel engine fuelled with next-generation advanced biofuel – diesel blends using response surface methodology. Energy Conversion and Mannagement, v. 123, p. 470 – 486, 2016. LI, Y.; ZHANG, D.; XI, X.; SHEN, Y.; CHANG, S.; ZHU, J.; CHEN, Y.; JIANG, L.; ZHANG, J. Noble metal-free bimetallic NiCo decorated Zn0,5Cd0,5S solid solution for enhanced photocatalytic H2 evolution under visible light. Hydrogen Energy, v. 45, p. 8300 – 8309, 2020. LIAO, G.; CHEN, S.; QUAN, X.; YU, H.; ZHAO, H. Graphene oxide modified g- C3N4 hybrid with enhanced photocatalytic capability under visible light irradiation. Journal of Materials Chemistry, v. 22, p. 2721, 2012. LIU, C., ZHANG, Y., WU, J., DAI, H., MA, C., ZHANG, Q., ZOU, Z. Ag-Pd alloy decorated ZnIn2S4 microspheres with optimal Schottky barrier height for boosting visible-light driven hydrogen evolution. Journal of Materials Science & Technology, v. 114, p. 81 – 89, 2022. SANTOS, J. A. F. A.; JONG, P.; COSTA, C. A.; TORRES, E. A.Combining wind and solar energy sources: Potential for hybrid power generation in Brazil. Utility Policy, v. 67, p. 101084, 2020. SARWAR, F., TAHIR, M., & ALIAS, H. Synergistic effect of photo-reduced Ni–Ag loaded g-C3N4 nanosheets for efficient visible Light‐Driven photocatalytic hydrogen evolution. Materials Science in Semiconductor Processing, v. 137, 106187, 2022. SARWAR, F.; TAHIR, M.; ALIAS, H. Synergistic effect of photo-reduced Ni-Ag loaded g-C3N4 nanosheets for efficient visible Light-Driven photocatalytic hydrogen evolution. Materials Science in Semiconductor Processing, v. 137, p. 106187, 2022. SCHENCKERY, M., BOLLINO, C. A., CARTON, J. G., CHAE, Y., FARGERE, A., KOLODZIEJCZYK, B. Adaptive Policy to leverage hydrogen in the energy transition. Disponivel em: < https://www.g20-insights.org/policy_briefs/adaptive-policy-to-leverage-hydrogen-in-the-energy-transition/>. Acesso em: 20 jun. 2022. SERPONE, N. Photocatalysis, Kirk-Othmer Encyclopedia of Chemical Technologuy, 2000. SPANU, D., RECCHIA, S., MOJAJERNIA, S., TOMANEC, O., KMENT, S., RADEK, Z., SCHMUKI, P., ALTOMARE, M. Templated dewetting – alloying of NiCu on TiO2 nanotubes enables efficient noble-metal-free photocatalytic H2 evolution. ACS Catalysis, v. 8, p. 5298 – 5305, 2018. TAHIR, M. La-modified TiO2/carbon nanotubes assembly nanocomposite for efficient photocatalytic hydrogen evolution from glycerol-water mixture. International Journal of Hydrogen Energy, v. 44, p. 3711 – 3725, 2019. TIAN, H., KANG, S. Z., LI, X., QIN, L., JI, M., MU, J. Fabrication of an efficient noble metal-free TiO2 based photocatalytic system using Cu – Ni bimetallic deposit as an active center of H2 evolution from water. Solar Energy Materials & Solar Cells, v. 134, p. 209 – 317, 2015. XIAO, N.; LI, S.; LIU, S.; XU, B.; LI, Y.; GAO, Y.; GE, L.; GUIWU, L. Novel PtPd alloy nanopartcile-decorated photocatalytic activity for H2 evolution under visible light irradiation. Chinese Journal of Catalysis, v. 40, p. 352 – 361, 2019. ZHANG, W., LI, W., LI, Y., PENG, S., XU, Z. One-step synthesis of nickel oxide/nickel carbide/graphene composite for efficient dye-sensitized photocatalytic H2 evolution. Catalysis Today, v. 335, p. 326 – 332, 2019. ZHONG, W.; GAO, D.; YU, H.; FAN, J.; YU, J. Novel amorphous NiCuSx H2-evolution cocatalyst: Optimizing surface hydrogen desorption for efficient photocatalytic activity. Chemical Engineering Journal, v. 419, p. 129652, 2021.
















