Autores
Monroy-cardenas, M. (UNIVERSIDAD DE TALCA) ; Martinez-cifuentes, M. (UNIVERSIDAD DE CONCEPCION) ; Araya-maturana, R. (UNIVERSIDAD DE TALCA)
Resumo
En el presente trabajo se desea comprender como influye la posición de uno o más
grupos metilo en el comportamiento del enlace de hidrógeno intramolecular de
derivados de juglona, debido al interés que presentan estas moléculas como
antioxidantes. Para esto, se sintetizó una serie de metil derivados de la 2,3-
dimetiljuglona de acuerdo a Valderrama et al. (1980) y se calcularon sus
energías de disociación de enlace (DBE) mediante el uso de la Teoría del
Funcional de la Densidad (DFT), además del estudio de la fuerza del enlace de
hidrógeno intramolecular mediante NBO. Con esto se pudo relacionar la DBE y la
energía de perturbación de segundo orden con los desplazamientos químicos en 1H-
RMN de los grupos hidroxilos fenólicos, encontrando una correlación de R2=0.94 y
R2=0.97 respectivamente.
Palavras chaves
Juglona; Calculos DFT; Puente de hidrogeno
Introdução
El estrés oxidativo se define como un desequilibrio entre especies reactivas de
oxígeno (ROS) y la capacidad antioxidante endógena, generando problemas en la
señalización celular, la regulación del ciclo celular, la apoptosis y la
expresión génica(Chen et al. 2018; Nowak et al. 2017). Los antioxidantes
naturales, entre los que se encuentran los compuestos fenólicos, pueden inhibir
el estrés oxidativo al reaccionar con las ROS. La transferencia de un átomo de
hidrógeno (HAT) de un grupo hidroxilo fenólico, o la transferencia
monoelectrónica (SET) son los principales mecanismos implicados en su capacidad
antioxidante. Aunque ambos pueden actuar simultáneamente, la capacidad
antioxidante dependerá de la energía de ionización involucrada. Cuanto menor sea
esta, más fácilmente será donado un electrón desde molécula
antioxidante(Leopoldini et al. 2004). Por otra parte, Se ha descrito que los
enlaces de hidrógeno participan en las interacciones de las moléculas
biológicamente activas, son clave en la estabilidad de los radicales libres y
pueden observarse fácilmente mediante espectroscopia de 1H-RMN(Kuhn, Mohr, and
Stahl 2010). Debido a esto, se han evaluado la existencia y fuerza de este tipo
de interacciones, al igual que las energías de disociación de enlace,
permitiendo mejorar la comprensión entre las relaciones estructura actividad en
resultados experimentales(Martínez-Cifuentes et al. 2017).
En este estudio elegimos cuatro derivados metílicos de la 2,3-dimetiljuglona,
además de la juglona y la dimetiljuglona, para estudiar in silico la variación
de la fuerza del enlace de hidrógeno en función de la inclusión de grupos metilo
en distintas posiciones, relacionándolos con un parámetro experimental como lo
es el desplazamiento del hidroxilo fenólico en 1H-RMN.
Material e métodos
La síntesis de las hidroquinonas de partida se realizó mediante un procedimiento
modificado del descrito por Donoso-Bustamante et al. (2020). Se utilizaron tubos
sellados de alta presión de 10 mL y la reacción se mantuvo en un reactor
Monowave 50 Anton Paar a 140°C por 30 min. La síntesis de las correspondientes
enaminas se realizó mediante el procedimiento descrito por Zhang et al. (2016)
y se purificaron por destilación a presión reducida. Posteriormente, se siguió
el procedimiento descrito por Castro et al. (1983) para la síntesis de juglonas.
El primer paso es la síntesis de los benzofuranos correspondientes, seguido por
un reordenamiento para obtener una naftohidroquinona o directamente la juglona.
Las naftohidroquinonas originan la acetiljuglona mediante un reordenamiento
dienona-fenolcon anhidrido acético en medio ácido. Por último, se obtiene la
correspondiente juglona mediante la hidrólisis en medio acido.
Todos los espectros de RMN se adquirieron usando un espectrómetro Bruker AVANCE
DRX 300 (Bruker BioSpin GmbH, Rheinstetten, Alemania) que opera a 300,13 MHz
(1H) o 75,47 MHz (13C) y usando CDCl3 como disolvente a 300 K. Los
desplazamientos químicos se informan en ppm por debajo del campo de TMS para
1HNMR y en relación con la resonancia central de CDCl3 (77,0 ppm) para 13CNMR.
Los cálculos teóricos se realizaron con el programa Gaussian 09 utilizando la
teoría del funcional de la densidad (DFT), con un nivel M062-x y un conjunto de
funciones bases 6-311+G(d, p). No se encontraron frecuencias imaginarias. Se
utilizó el modelo continuo polarizable de tipo conductor (C-PCM) para modelar el
medio, en este caso agua. Los cálculos de NBO se realizaron utilizando las
mismas estructuras optimizadas y el programa NBO 7.0.
Resultado e discussão
Las hidroquinonas I y II se obtuvieron con rendimientos de 76% y 78%
respectivamente, prácticamente el doble de lo reportado previamente. Los
benzofuranos V-VIII se obtuvieron con rendimientos que van del 46 al 71%.
Aquellos con un grupo gem-dimetilo, generan las juglonas MJ43 y MJ44, en 3
etapas con rendimientos globales de 65% y 53% respectivamente. Mientras que para
la obtención de MJ41 y MJ42 obtuvieron los productos con un 7,2% y un 2,8% de
rendimiento en una etapa.
En los estudios teóricos y especteroscópicos de 1H-RMN se incluyeron la juglona
y la dimetiljuglona. Se observó que la inclusión de los metilos en el anillo
quinónico disminuye la DBE en 0.02 Kcal/mol y aumenta la (E(2)) en 1.23
Kcal/mol, generando un desplazamiento de la señal del protón fenólico hacia
campo más bajo. En el anillo fenólico se observa que para MJ41 y MJ43 la
ausencia de un metilo en posición orto genera que sus DBEs sean mayores y sus
E(2) menores con respecto a MJ42 y MJ44. Esto también se ve reflejado en los
desplazamientos del protón fenólico, donde tanto MJ41 como MJ43 presentan un
δ=12.77 ppm. Mientras que, aunque queda establecida la importancia del grupo
metilo en posición orto, la inclusión de un metilo adicional en MJ44, con
respecto a MJ42, genera una disminución en la DBE de 0.33 kcal/mol y un aumento
de 0.33 Kcal/mol en la E(2), esto se ve reflejado en el desplazamiento de los
protones hidroxílicos en donde MJ44 se desplaza en 0.26 ppm hacia campo más bajo
con respecto a MJ42.
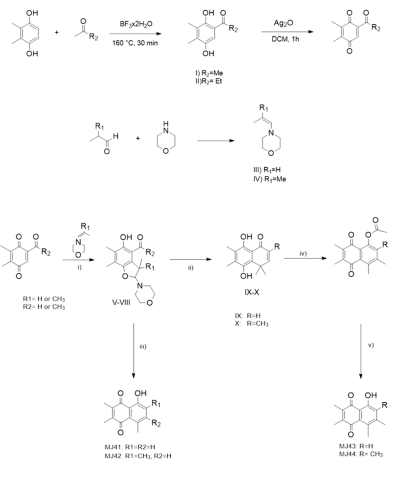
i) DCM, 0°C a t.a., 8 h; ii) H+/EtOH, reflujo, 1h; iii) H2SO4 10%:Acetone 1:1, reflujo 1h; iv) Ag2O/DCM, 1h a t.a., anhidrido acetico; v) H+/dioxano
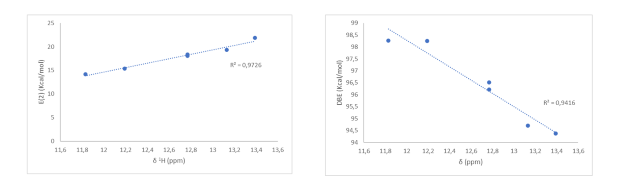
E(2): energía de perturbación de segundo orden DBE : energía de disociacion de enlace
Conclusões
Estos resultados muestran que los cálculos de DBE y NBO dan
una buena descripción de la modulación de propiedades moleculares generadas por
cambios estructurales, esto se observa en las buenas correlaciones obtenidas,
R2=0.94 para las DBE y R2=0.97 para las E(2).
Agradecimentos
Agradecimientos a los proyectos FONDECYT 1221874 y 11170142, al ACT210097 y al
programa de doctorado en Investigacion y Desarrollo de Compuestos Bioactivos de la
Universidad de Talca.
Referências
Castro, Christian G., José G. Santos, Juan C. Valcárcel, and Jaime A. Valderrama. 1983. “Kinetic Study of the Acid-Catalyzed Rearrangement of 4-Acetyl-3,3-Dimethyl-5-Hydroxy-2-Morpholino-2,3-Dihydrobenzo[b]Furan.” Journal of Organic Chemistry 48(18): 3026–29.
Chen, Qishan et al. 2018. “Reactive Oxygen Species: Key Regulators in Vascular Health and Diseases.” British Journal of Pharmacology 175(8): 1279–92.
Donoso-Bustamante, Viviana et al. 2020. 100 Bioorganic Chemistry An Acylhydroquinone Derivative Produces OXPHOS Uncoupling and Sensitization to BH3 Mimetic ABT-199 (Venetoclax) in Human Promyelocytic Leukemia Cells. Elsevier Inc. https://doi.org/10.1016/j.bioorg.2020.103935.
Kuhn, Bernd, Peter Mohr, and Martin Stahl. 2010. “Intramolecular Hydrogen Bonding in Medicinal Chemistry.” Journal of Medicinal Chemistry 53(6): 2601–11.
Leopoldini, Monica, Tiziana Marino, Nino Russo, and Marirosa Toscano. 2004. “Antioxidant Properties of Phenolic Compounds: H-Atom versus Electron Transfer Mechanism.” Journal of Physical Chemistry A 108(22): 4916–22.
Martínez-Cifuentes, Maximiliano et al. 2017. “A Study about Regioisomeric Hydroquinones with Multiple Intramolecular Hydrogen Bonding.” Molecules 22(4).
Nowak, Witold N., Jiacheng Deng, Xiong Z. Ruan, and Qingbo Xu. 2017. “Reactive Oxygen Species Generation and Atherosclerosis.” Arteriosclerosis, Thrombosis, and Vascular Biology 37(5): e41–52.
Zhang, Yuhan, Yonghong Guo, Zhongle Li, and Zhixiang Xie. 2016. “Biomimetic Total Synthesis of Paeoveitol.” Organic Letters 18(18): 4578–81.
















