Autores
Ribeiro, J.C.O. (UEG) ; Carvalho-silva, V.H. (UEG) ; Rosseto, R. (UEG)
Resumo
O sulfeto de hidrogênio é um composto tóxico e pode ser letal. Pode ser gerado a
partir de vários processos, sendo naturais ou industriais. Visto tais aspectos,
é necessário o desenvolvimento de materiais capazes de remover esse tipo de
composto, os hidróxidos duplos lamelares, se mostram promissores quando
utilizados como adsorvente na remoção de poluentes. Porém sua estrutura e
mecanismos de interação não são de fácil compreensão, então a química
computacional pode auxiliar na compreensão dessas estruturas e propriedades.
Esse trabalho buscou a compreensão da interação entre o HDL Zn/Al e o H2S.
Utilizando métodos computacionais baseados na teoria do funcional da densidade
com a correlação B3LYP/STO-6g. As análises estruturais e geométricas
demonstraram bons parâmetros.
Palavras chaves
Adsorção; Parâmetros Estruturais; Interação
Introdução
O grande crescimento do setor industrial levou a melhorias no estilo de vida das
pessoas, facilitando o acesso a diversos tipos de produtos e tecnologias. Apesar
dos benefícios, esse aumento da atividade tem consequências como o aumento da
poluição, produzindo poluição na atmosfera e nas fontes aquosas. Existem
diversos compostos utilizados no setor industrial, um dos quais pode ser
destacado pelo sulfeto de hidrogênio (H2S), que em alguns casos atua como
protagonista e parceiro para a saúde humana, mas em outros casos, em altas doses
pode até causar a morte . (MASI; ASCENZI, 2012).
Uma vez que este composto apresenta importantes funções dentro da indústria
química, podendo ser precursor de novos compostos ou produtos que serão
descartados, faz-se necessário o desenvolvimento de métodos para sua remoção e
recuperação. Dessa forma, os hidróxidos lamelares duplos (HDL) apresentam-se
como mais um método promissor para a remoção e recuperação de poluentes (WANG;
MATSON, 2019).
HDLs, também conhecidos como compostos semelhantes a hidrotalcita, são uma
família de compostos que podem ocorrer em baixas frequências naturais ou são
facilmente sintetizados. Sua composição é semelhante à brucita (Mg(OH)2), um
mineral natural, com lamelas compostas de hidróxido de magnésio. A estrutura das
HDLs pode ser explicada pela formação de lamelas com cátions di e trivalentes,
que geram uma carga residual, que precisa ser estabilizada por meio de espécies
aniônicas (GUO et al., 2010).
Esses compostos podem ser combinados com diferentes combinações de cátions e
ânions lamelares na região interlamelar. Esses tipos de composição permitem que
as propriedades únicas do HDL sejam muito interessantes, como baixa toxicidade,
troca iônica, estabilidade térmica, alta área superficial, entre outras. Devido
a essas características, as HDLs têm sido utilizadas em diversas áreas, como
catalisadores e suporte para catalisadores, sensores eletroquímicos,
biossensores, carreadores de drogas e adsorventes (BENÍCIO et al., 2017;
GUALANDI et al., 2019).
Além do desenvolvimento de novos materiais, a simulação computacional é uma
importante ferramenta para o entendimento de estruturas, caracterizando e
prevendo processos, na busca de um melhor entendimento das estruturas e
interações entre sistemas químicos, proporcionando baixos custos operacionais.
Portanto, a química computacional tem sido amplamente utilizada para prever o
comportamento da transformação de poluentes no ambiente natural e sistemas
aquáticos (HE et al., 2021). contribuir. na compreensão da absorção de poluentes
na água utilizando HDL, como adsorventes promissores para aplicações
industriais.
O conhecimento de determinados parâmetros, como estrutura e termodinâmica,
permite sugestões simples quanto às aplicações do HDL, mas a falta de
informações sobre tais parâmetros desses materiais reduz o potencial que pode
ser testado. Portanto, o presente trabalho visa estudar a interação entre a
composição de hidróxidos lamelares duplos de Zn/Al e sulfeto de hidrogênio
utilizando métodos de estrutura eletrônica quântica, a fim de determinar as
propriedades geométricas e eletrônicas envolvidas na interação entre esses
compostos.
Material e métodos
Os cálculos computacionais foram realizados utilizando o programa GaussView em
conjunto com o programa Gaussian09 (FRISCH et al.,2009). O software Multiwfn,
também foi
utilizado para a obtenção das regiões de densidade eletrônica presentes entre a
interação HDL-H2S. As estruturas dos HDL foram obtidas através do The Cambridge
Crystallographic Data Centre (CCDC). Depois de obtida as estruturas os cálculos de
otimização das estruturas foram realizados utilizando a correlação B3LYP com o
conjunto de base STO-6g para a estrutura do HDL, para a estrutura do H2S e para o
sistema HDL-H2S.
Resultado e discussão
Definições das estruturas e preparação dos cálculos
Os compostos do tipo Mg(OH)2 são compostos muito simples, portanto, com base em
sua estrutura, podem ser um bom ponto de partida, devido à sua pequena estrutura
em comparação com os HDL. Em seguida, as estruturas de HDL/Zn-Al no formato CIF
foram obtidas do banco de dados cristalográfico do CCDCC. Uma vez obtida a
estrutura, foi então pensado uma maneira de reduzi-la a uma forma que
representasse o todo do sólido, pois o cálculo da estrutura completa demandaria
muito tempo e custo computacional. Reduzindo o número de átomos metálicos nas
lamelas e removendo as moléculas da região interlamelar chegou-se à estrutura
representada na figura 1.
Para otimização da estrutura, foram utilizadas as palavras-chave opt=readfreeze,
que são usadas para definir variáveis durante a otimização; freq=noraman,
utilizado para determinar a frequência sem intensidade Raman; nosymm, que impede
a reorientação da molécula e faz com que todos os cálculos sejam realizados na
orientação de entrada; int=ultrafine, que aumenta muito a precisão dos cálculos
a um custo adicional razoável; scf=xqc, que é usado em situações de conversão
difíceis.
O processo de otimização de geometria é um processo que busca a configuração de
energia mínima de uma molécula. Usando uma determinada geometria inicial, o
processo calcula a função de onda e a energia dessa geometria e procura a
geometria de menor energia. O resultado da estrutura mais estável é obtido
quando a maioria dos vetores de força em todos os átomos está abaixo da
tolerância pré-estabelecida (COSTA et al., 2010).
Análise estrutural e geométrica
Inicialmente, a estrutura do H2S foi montada e otimizada, utilizando os
parâmetros citados acima, os resultados mostram uma otimização que produz
ângulos e comprimentos de ligação próximos aos descritos na literatura em 92° e
133,6 para a molécula de H2S (GONÇALVES; CASTIE; FRANCO, 2022).
A partir da estrutura de HDL escolhida, foi montada uma estrutura prismática
octaédrica, e a otimização foi realizada utilizando os mesmos parâmetros
utilizados para a otimização da molécula de H2S.
Ao analisar a estrutura não otimizada, observa-se a distância de ligação entre
O-H de 112 pm, O-Al de 203 pm e O-O de 266 pm. Quanto aos ângulos de ligação,
foram encontrados H-O-Al 119,2° e O-Al-O 49,0°. Para a estrutura otimizada, os
valores de comprimento de ligação foram O-H 104 pm, O-Al 187 pm e O-O 275 pm.
Quanto aos ângulos de ligação, foram encontrados H-O-Al 99,6° e O-Al-O 42,6°.
Analisando os resultados obtidos, é possível notar que houve uma diminuição
significativa nos comprimentos de ligação e angulações entre as estruturas
otimizadas e não otimizadas. Isso mostra que a estrutura foi otimizada
encontrando a geometria de menor energia dentro dos parâmetros utilizados. Outro
ponto importante a ser observado é que houve uma mudança de configuração na
estrutura otimizada, os átomos de oxigênio não ligados se afastam devido à forte
repulsão eletrônica entre eles após a redução do comprimento de ligação entre O-
Al, outra observação que pode ser feita é a de que os átomos de hidrogênio
também se reorganizaram formando ligações de hidrogênio em toda a estrutura, o
que confere maior estabilidade para a estrutura final.
Após a otimização dos parâmetros geométricos de H2S e HDL, a estrutura foi então
montada e a otimização da interação entre HDL e H2S foi realizada. A molécula de
H2S e a molécula de água (H2O) possuem um eixo de simetria C2, então o eixo C2
da molécula de H2S está disposto paralelamente às lamelas como a brucita, que
segundo David e Slade (2006), existe uma preferência para essa configuração.
Desta forma, a molécula de H2S foi colocada no centro do sítio prismático
formado pelos grupos hidroxila.
A partir do resultado obtido é possível observar uma mudança significativa
quando comparadas as estruturas iniciais e a estrutura otimizada, sendo que a
estrutura otimizada mostra a quebra das ligações entre os átomos de hidrogênio e
enxofre da molécula de H2S adsorvida. O átomo de enxofre permaneceu fixo no
centro devido aos parâmetros utilizados enquanto os átomos de hidrogênio se
posicionaram em direção aos grupos hidroxila do material
O resultado obtido mostra a formação de sulfeto S2- e 2H+, os átomos de H+ são
estabilizados por ligações de hidrogênio enquanto S2- é estabilizado pela doação
de densidade eletrônica dos átomos de hidrogênio presentes nos grupos hidroxila,
que está de acordo com dados experimentais, uma vez que é necessário a
intercalação de um contra íon para estabilizar as cargas residuais positivas da
estrutura lamelar formada pelos metais (WANG et al, 2019).
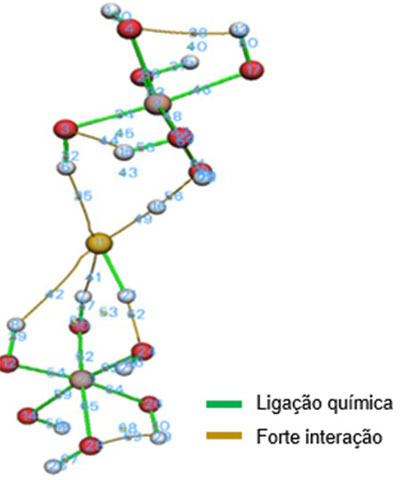
Para verificar os resultados obtidos, o software multiwfn foi utilizado para
realizar uma análise de densidade eletrônica da estrutura do HDL-H2S, a partir
desta análise é possível visualizar um mapa de ligações efetivas e regiões de
alta densidade eletrônica, indicando fortes interações (ZHU et al, 2022).
As linhas de cor verde representam a ligação química efetiva, enquanto as linhas
de cor amarela representam as regiões de densidade eletrônica, que mostra a
interação entre os átomos. De acordo com o resultado obtido, é possível observar
que a ligação entre o átomo de enxofre (11) e um dos átomos de hidrogênio (16)
foi rompida, enquanto o outro átomo de hidrogênio (21) permaneceu ligado ao
átomo de enxofre. Além disso, é possível observar a interação entre as ligações
de hidrogênio formadas entre a própria estrutura do HDL e entre a estrutura do
HDL-H2S.
Dessa forma, apenas uma ligação de hidrogênio da molécula de H2S foi quebrada, o
que levou à formação de HS- e H+, além da análise de densidade eletrônica, ao
observar a distribuição de cargas na molécula de H2S, observou-se que a carga de
enxofre era duas vezes maior após a interação com HDL, que indica o rompimento
de apenas uma ligação com hidrogênio.
Analise termodinâmica
Para obtenção de materiais e suas propriedades, a análise termodinâmica é muito
importante. Para ajudar a entender as propriedades estudadas ao longo deste
trabalho, as energias de interação entre as espécies foram calculadas para
determinar se a reação foi favorável ou não.
Assumindo o equilíbrio termodinâmico para a reação em questão, a entalpia de
formação e a energia livre de Gibbs são calculadas da seguinte forma:
ΔE=[EHDL-H2S-(EH2S+EHDL)] (1)
E é entalpia (H), energia livre de Gibbs (G) ou entropia (S).
A Tabela 1 mostra os resultados obtidos já transformados pelo cálculo feito pela
equação 1.
O resultado mostrado na Tabela 2 mostra valores negativos de ΔG, o que indica
que a ocorrência de interação entre a molécula de HDL e H2S foi espontânea. Esta
reação também apresentou um valor de entalpia negativo, o que sugere que a
dissociação que ocorre durante a adsorção tem caráter exotérmico. Esses valores
indicam que interações eletrostáticas e ligações de hidrogênio favorecem a
permanência das espécies de HS formadas na interação.
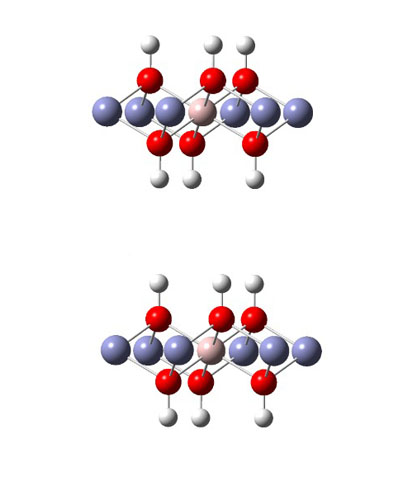
Estrutura reduzida do HDL obtida através do banco de dados do CCDC, omitindo as moléculas de agua e os aníons da região interlamelar.
Conclusões
Hidróxidos duplos lamelares são compostos promissores em diversos campos de
aplicação, entender as propriedades desses compostos é importante para o
desenvolvimento de materiais de alto desempenho. Com o auxílio da química
computacional, é possível um melhor entendimento desse tipo de sistema, porém
sistemas com grande número de átomos e elementos como os do HDL tornam-se mais
complexos e possuem alto custo computacional.
O desafio deste trabalho foi propor um modelo reduzido da estrutura lamelar e
fazer interações com a molécula de interesse, analisando e comparando suas
propriedades iniciais e finais para detectar alterações na geometria, estrutura
eletrônica e propriedades termodinâmicas.
A estrutura selecionada apresentou resultados consistentes em sua geometria,
apresentando menores comprimentos de ligação e menores angulações quando
otimizada. Os resultados de densidade eletrônica mostram a forte interação das
ligações de hidrogênio presentes em todo o sistema, o que lhe confere grande
estabilidade. A energia livre de Gibbs mostra o processo espontâneo na inserção
da molécula de H2S dentro da estrutura lamelar, resultado que mostra
propriedades termodinâmicas favoráveis.
Apesar do modelo simples utilizado, pode-se supor que a simulação é bem
sucedida, é possível analisar vários parâmetros juntos, mesmo utilizando baixo
custo computacional. Desta forma, este estudo abre novas perspectivas para
trabalhos futuros, visando a criação de um modelo mais robusto e completo capaz
de reproduzir a estrutura principal, discriminando as interações interlamelares,
e as moléculas de água presentes e a redução ou expansão da área interlamelar.
Agradecimentos
Os autores gostariam de agradecer a agencia de fomento FAPEG pelo apoio financeiro
e ao Centro de Computação de Alto Desempenho da Subsecretaria de Tecnologia da
Informação (STI/SEDI), Goiás, Brasil.
Referências
BENÍCIO, L. P. F.; CONSTANTINO, V. R. L.; PINTO, F. G.; VERGÜTZ, L.; TRONTO, J.; COSTA, L. M. Layered Double Hydroxides: New Technology in Phosphate Fertilizers Based on Nanostructured Materials. ACS Sustainable Chemestry, Eng. v. 5, p. 399-409, 2017.
COSTA, D, G.; ROCHA, A. B.; DINIZ, R.; SOUZA, W. F.; CHIARO, S. S. X.; LEITÃO, A. A. Structural Model Proposition and Thermodynamic Vibrational Analysis of Hydrotalcite -Like Compounds by DFT Calculations. Journal of Physical Chemistry C, v. 114, p. 14133-14140, 2010.
GONÇALVES, A. F.; CASTIER, M.; FRANCO, L. The role of cross-association between carbon dioxide and hydrogen sulfide using the SAFT-VR Mie equation of state. Fluid Phase Equilibria, v. 559, p. 1-12, 2022.
GUALANDI, I.; VLAMIDIS, Y.; MAZZEI, L.; MUSELLA, E.; GIORGETTI, M.; CHRISTIAN, M.; MORANDI, V.; SCAVETTA, E.; TONELLI, D. Ni/Al Layered Double Hydroxide and Carbon Nanomaterial Composites for Glucose Sensing. ACS Applied Nano Materials, v. 2, p. 143-155, 2019.
GUO, X.; ZHANG, F.; EVANS, D. G.; DUAN, X. Layered double hydroxide films: synthesis, properties and applications. Chemical Communications, v. 46, n. 29, p. 5197–5210, 2010.
HE, L.; BAI, L.; DIONYSIOU, D. D.; WEI, Z.; SPINNEY, R.; CHU, C.; XIAO, R. Applications of computational chemistry, artificial intelligence, and machine learning in aquatic chemistry research. Chemical Engineering Journal, v. 426, n. 131810, p. 1-6, 2021.
MASI, A. D.; ASCENZI, P. H2S: A “Double face” molecule in health and disease. BioFactors, v. 39, n. 2, p. 186–196, 2012.
SELLAOUI, L.; YAZIDI, A.; ALI, J.; DOTTO, G. L.; BONILLA-PETRICIOLET, A.; OLIVEIRA, L. F. S.; CHEN, Z. Theoretical study and analysis of o-nitrophenol adsorption using layered double hydroxides containing Ca-Al, Ni-Al and Zn-Al. Environmental Science and Pollution Research, v. 28, n. 32, p. 44547–44556, 2021.
WANG, J.; ZHANG, L.; ZHANG, T.; DU, T.; LI, T.; YUE, T.; LI, Z. Selective removal of heavy metal ions in aqueous solutions by sulfide-selector intercalated layered double hydroxide adsorbent. Journal of Materials Science & Technology, v. 35, p. 1808-1816, 2019.
ZHU, S.; CHEN, Y.; KHAN, M. A.; XU, H.; WANG, F.; XIA, M. In-Depth Study of Heavy Metal Removal by an Etidronic Acid-Functionalized Layered Double Hydroxide. ACS Applied Materials & Interfaces, v. 14, n. 5, p. 7450-7463, 2022.
















