Autores
Ferreira, L. (UEMA) ; Santos, P.L.L. (UEMA) ; Silva, L.G.P. (UEMA) ; Gomes, T.F. (UEMA) ; Gonçalves, J.C.S. (UEMA) ; Oliveira, A.L.T. (UEMA) ; Fernandes, R.M.T. (UEMA) ; Khan, A. (UEMA)
Resumo
O uso dos combustíveis fósseis aconteceu paralelamente ao início da Revolução
Industrial. O álcool, à base de cana-de-açúcar, fora o primeiro combustível
renovável a ser utilizado em larga escala, e em comparação aos derivados do
petróleo. Outrora outra substância que também vem se destacando como propelente, é
o um composto hidreto do boro. Pesquisas trouxeram à tona, a relevância da
utilização do diborano como combustível aeroespacial. A partir desses comentários
acerca da importância do etanol e do diborano, como combustíveis promissores, no
que tange as pesquisas na área aeroespacial que este trabalho surge. Nesta
perspectiva este estudo é uma tentativa de avaliar as características das
propriedades de termodinâmicas.
Palavras chaves
Termodinâmica; Diborano ; DFT
Introdução
O uso dos combustíveis fósseis aconteceu paralelamente ao início da Revolução
Industrial, com o advento da máquina a vapor e locomotivas, que utilizavam como
energia o carvão mineral. Esse combustível é formado pela fossilização da
madeira, que vai perdendo água, dióxido de carbono e metano com o passar do
tempo, o que produz uma mistura de substâncias complexas ricas em carbono, cujo
pode variar de acordo com seu tempo de formação e maturidade, podendo ser
classificado de acordo com o teor de carbono e poder calorífico. (ROCHA et.al.,
2013)
Nessa perspectiva e preocupado com os danos nocivos ao meio ambiente, o Brasil
vem se destacando em pesquisas acerca dos biocombustíveis. Fontes naturais como
o bagaço de cana de açúcar tem se mostrado viável do ponto de vista econômico e
na produção do etanol. (GONÇALVES, 2010) Outrora outra substância que também vem
se destacando como propelente, é o um composto hidreto do boro. Pesquisas que
datam de meados de 1947, 1948 e 1952 trouxeram à tona, a relevância da
utilização do diborano como combustível aeroespacial. Isso porque este composto
apresenta boas propriedades como o seu manuseio, armazenamento, ignição,
qualidades de combustão e não se pode deixar de lado o seu ponto de ebulição.
Nesta perspectiva este estudo é uma tentativa de avaliar as características
termodinâmicas, em busca de determinar os parâmetros de taxa para a reação de
dissociação primeira e abstração nas reações de decomposição térmicas das
moléculas de interesses , das matérias de alta energias conhecidas como
propelentes ou combustíveis especiais.
Material e métodos
Inicialmente, as moléculas foram modeladas usando a programa Gaussview 5.0,
considerando os dados experimentais para as ligações de cada molécula de interesse
B-B, B-H, B-O, O-O, H-H, O-H. Todos os cálculos foram calculados pelo programa
Gaussian utilizando método DFT (B3LYP) com função de base cc-pVTZ. Os cálculos das
reações foram computados em temperaturas distintas de 100K, 298K, 500K e 1000K,
assim fora possível extrair do arquivo de saída do Gaussian 09 as propriedades
termodinâmicas tais como Variação de entalpia, Energia Livre de Gibbs. As
grandezas termodinâmicas foram calculadas tomando como base a diferença entre
produtos e reagentes.
Resultado e discussão
Verificou-se que as reações I, II e III são exotérmicas. Geralmente, para
reações exotérmicas, ocorre diminuição de entalpia quando há aumento de
temperatura. A variação de entalpia é definida termodinamicamente como sendo a
quantidade de calor trocada a pressão constante. Para representar que o calor
foi liberado uma das formas utilizadas é ∆H<0. Consequentemente para reações
endotérmicas utiliza-se ∆H>0. Comparando as reações I e II é possível observar
que enquanto a quantidade de calor liberada vai diminuindo com o aumento da
temperatura na reação I, o que é esperado, a quantidade de calor liberada na
reação II vai aumentando.
A variação de entropia é uma grandeza termodinâmica referente ao grau de
desordem dos sistemas. Nas reações químicas é possível inferir que houve aumento
ou diminuição de entropia através do sinal. Processos que ocorrem com aumento de
entropia são representados por ∆S>0 e processos que ocorrem com diminuição de
entropia são representados por ∆S<0. A reação I ocorrem com aumento de entropia
enquanto as demais ocorrem com diminuição de entropia. Na reação II e III
observa-se um comportamento que não atende ao padrão. O aumento de temperatura
de 500 K para 1000 K provoca diminuição de entropia.
A variação de energia livre de Gibbs em reações exotérmicas com aumento de
entropia, como no caso da reação I, o aumento da temperatura torna a reação mais
espontânea. A reação II com aumento de temperatura diminui sua espontaneidade
por fim na reação III perde a espontaneidade com o aumento da temperatura,
porém em 1000K volta ao seu valor inicial.
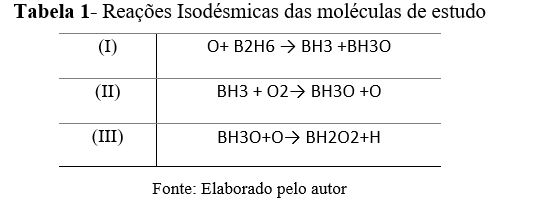
Reações Isodésmicas das moléculas de estudo
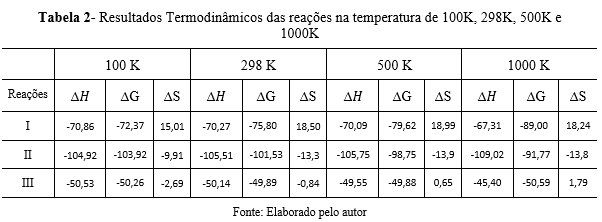
Resultados Termodinâmicos das reações na temperatura de 100K, 298K, 500K e 1000K
Conclusões
De posse dos resultados concluímos que a técnica de reação isodésmica tem muito
sucesso em determinar os tipos de reações de combustão, e nos ajudou a esclarecer
quais das reações estão envolvidas na absorção do calor produzido durante o
processo. Observou-se que as reações I, II e III são reações com alto valor da
variação da energia de Gibbs (negativa) e que liberam alta valor de energia para
o meio.
Agradecimentos
À UEMA pela concessão da bolsa e pelo fomento da pesquisa. Ao Laboratório de
Físico-Química da UEMA, e ao professor Alamgir Khan.
Referências
ROCHA, Gisele Olímpio da. Et.al QUÍMICA SEM FRONTEIRAS: O DESAFIO DA ENERGIA. Quim. Nova, Vol. 36, No. 10, 1540-1551, 2013.
GONÇALVES, Fernando dos santos. Petróleo e Combustíveis Industriais: Mercado e Aplicações. Trabalho de Conclusão de Curso de Engenharia Química. Universidade Federal do rio Grande do Sul. Porto Alegre, 2010.
















