TÍTULO: USANDO A ANÁLISE CONFORMACIONAL PARA ESTUDAR QUÍMICA ORGÂNICA: RELATO DE PROJETO DE INICIAÇÃO CIENTÍFICA JÚNIOR EM QUÍMICA NA UFPB
AUTORES: BEZERRA, A.F. (UFPB) ; ANDRADE, R. B. (UFPB) ; DIAS, W.S. (UFPB) ; BARBOSA, V.M.S. (UFPB) ; SILVA, L.V. (UFPB) ; LOPES, K.C. (UFPB) ; ARAÚJO, R.C.M.U. (UFPB)
RESUMO: As propriedades físicas, químicas e biológicas de uma molécula normalmente dependem das diferentes conformações que esta pode adotar. Os diferentes confôrmeros de uma dada molécula podem apresentar diferenças ao redor de ligações simples, mudanças em ângulos, mudanças em comprimentos de ligações. O principal objetivo deste trabalho consiste em encontrar a conformação de menor energia para as moléculas propostas utilizando métodos computacionais, a fim de comparar os resultados obtidos com a literatura e, assim, proporcionar um melhor entendimento das propriedades moleculares para os alunos de ensino médio. Os aspectos de ensino-aprendizagem utilizando recursos computacionais também serão avaliados a fim de verificar a possibilidade da introdução desta metodologia em aulas no ensino médio
PALAVRAS CHAVES: ensino de química, análise conformacional, química orgânica
INTRODUÇÃO: Um dos recursos que vem sendo utilizado desde a década de 60 como instrumento para a aprendizagem é o computador. As possibilidades de uso desta tecnologia são muito grandes e, com o passar dos anos, tem evoluído e se modificado, como podemos constatar em alguns artigos selecionados para investigar a presença desta temática no universo da Química [1]. Esta ferramenta tem sido apontada como uma alternativa de atividade na prática pedagógica. No ensino da química, recursos que empreguem imagens e modelos que auxiliem na construção do conhecimento é de fundamental importância no processo de ensino-aprendizagem. Tendo em vista o currículo escolar da 3ª série do Ensino Médio, a Química Orgânica, por ser vasta, tanto em conteúdo, quanto em contextualização, aborda milhares de moléculas estruturais complexas necessárias ao funcionamento dos processos biológicos, fundamentais aos seres vivos [2]. Estes assuntos têm como objetivo a compreensão de conceitos abstratos, que (muitas vezes) fogem da realidade cognitiva dos alunos [3]. A Química Computacional no Ensino Médio é considerada complexa para o entendimento, pois parte de conceitos abstratos que são, na maioria das vezes, não intuitivos. Mas, a partir do que se refere a estrutura molecular, trazendo a integração da linguagem e dos conceitos científicos para um melhor entendimento do universo microscópico a partir do macroscópico, o nível de abstração do aluno pode ir se aprofundando ao observar as moléculas em seu aspecto tridimensional e conformacional [4]. A partir do exposto, este trabalho tem por objetivo aproximar o aluno do ensino médio da química computacional através da utilização de programas computacionais que auxiliem no melhor entendimento do conteúdo abordado em sala de aula.
MATERIAL E MÉTODOS: O programa computacional escolhido para este trabalho foi o Gaussian 03W [5] pois fornece várias informações sobre a molécula como energia, cargas atômicas, comprimento de ligações, ângulo de ligações, hibridização, orbitais moleculares, entre outras. Os cálculos foram realizados utilizando o método Hartree-Fock [6] e o DFT (Density Functional Theory) [7] com o funcional híbrido B3LYP [8,9] para ambos os métodos a base utilizada foi a de Pople 6-311++G(d,p) [10]. Foram realizados cálculos de barreira rotacional das moléculas de etano, propano e butano pelos alunos do 2° ano do ensino médio participantes do Programa de Iniciação Científica Júnior do Departamento de Química da Universidade Federal da Paraíba. A estrutura tridimensional das moléculas pode ser construída e visualizada utilizando o programa GaussView 5.0. Os cálculos de barreira rotacional foram realizados a partir da ligação central C-C para os alcanos selecionados para este estudo. A identificação das ligações rotáveis foi feita através do ângulo diedral livre com rotação de 0° a 360° utilizando um incremento pré-determinado de 1°. A busca termina quando todas as combinações possíveis de ângulos de torção moleculares tiverem sido obtidas e minimizadas.
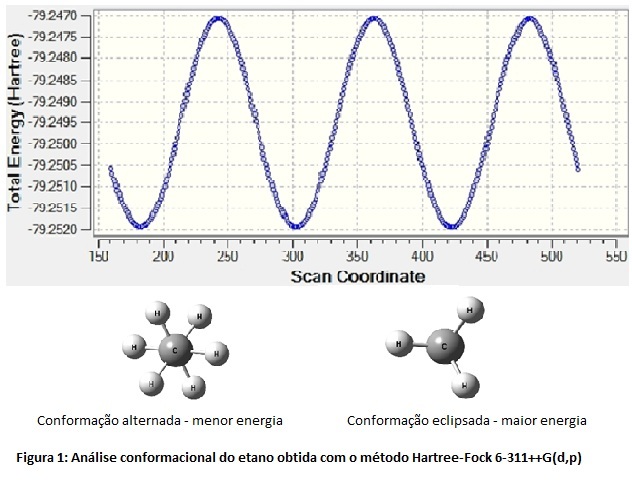
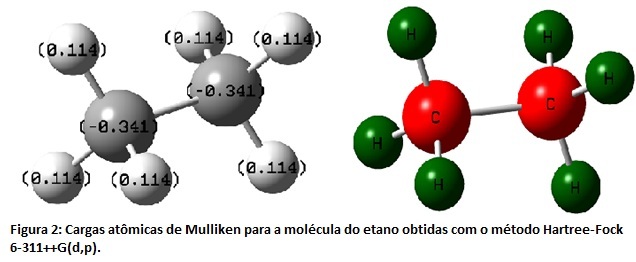
RESULTADOS E DISCUSSÃO: Com base nos cálculos realizados para as moléculas de etano, propano e butano os alunos puderam verificar a estabilidade das conformações através dos cálculos de barreira rotacional. A Figura 1 mostra a barreira rotacional encontrada para a molécula do etano, assim como as conformações de máximo e mínimo de energia encontradas em cada etapa da barreira. Com isso foi possível perceber que a conformação eclipsada é desfavorável devido às repulsões entre as nuvens eletrônicas dos átomos. Na conformação alternada há um máximo de afastamento entre os átomos, favorecendo a estabilidade desta conformação. A partir deste cálculo também foi possível comparar as diferenças de energia que cada método de cálculo apresenta. Este fato pode ser explicado pela forma com que cada método computacional aproxima as equações da Mecânica Quântica para calcular a função de onda. Os valores das cargas atômicas baseados na análise populacional de Mülliken [11] também foram obtidos com o objetivo de esclarecer a diferença de eletronegatividade existente entre os átomos. Na Figura 2 podem ser visualizados os valores das cargas atômicas obtidos para a molécula do etano utilizando o método de cálculo Hartree-Fock. Os átomos na cor vermelha apresentam maiores valores de carga atômica e, consequentemente, uma maior eletronegatividade, os átomos na cor verde apresentam valores menores de eletronegatividade e também menores valores de carga atômica.
CONCLUSÕES: É importante destacar o crescente interesse pela pesquisa científica por parte dos alunos de ensino médio participantes deste projeto. Inicialmente, a dificuldade diante dos programas computacionais parecia gerar uma situação desmotivadora, mas, o desafio de aprender foi tomando conta dos alunos e cada nova descoberta era feita com grande entusiasmo. A possibilidade de poder tornar o aprendizado de química mais atraente é uma forma de despertar o interesse dos alunos para as ciências, de forma que eles compreendam melhor os fenômenos que ocorrem em seu cotidiano e no mundo como um todo.
AGRADECIMENTOS: Ao CNPq pela bolsa concedida, ao Departamento de Química da UFPB e ao Laboratório de Química Quântica Computacional pelo espaço cedido.
REFERÊNCIAS BIBLIOGRÁFICA: 1 - RIBEIRO, A.A.; GRECA, I.M. Simulações Computacionais e ferramentas de modelização em educação química: uma revisão da literatura publicada. Química Nova, São Paulo, v. 26, n. 4, p. 542-549, 2003.
2 - ATKINS, P; JONES, L. Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente. Trad.: ALENCASTRO, R. B. et al. 3. Ed., Porto Alegre: Bookman, 2006.
3 - Good, R.; Berger, C. O computador como um mecanismo poderoso para a compreensão da ciência. In J. Mintzes, J. Wandersee e J. Novak (Eds.), Ensinando Ciência para a Compreensão – uma visão construtivista 2000.
4 - ARROIO, A; HONÓRIO, K. M; WEBER, K. C; MELLO, P. H; SILVA, A. B. F. 2005 [Online]. O ensino da química quântica e o computador na perspectiva de projetos. Homepage: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-4042200500020003
5 – Gaussian 03, Revision E.01, M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, J. A. Montgomery, Jr., T. Vreven, K. N. Kudin, J. C. Burant, J. M. Millam, S. S. Iyengar, J. Tomasi, V. Barone, B. Mennucci, M. Cossi, G. Scalmani, N. Rega, G. A. Petersson, H. Nakatsuji, M. Hada, M. Ehara, K. Toyota, R. Fukuda, J. Hasegawa, M. Ishida, T. Nakajima, Y. Honda, O. Kitao, H. Nakai, M. Klene, X. Li, J. E. Knox, H. P. Hratchian, J. B. Cross, V. Bakken, C. Adamo, J. Jaramillo, R. Gomperts, R. E. Stratmann, O. Yazyev, A. J. Austin, R. Cammi, C. Pomelli, J. W. Ochterski, P. Y. Ayala, K. Morokuma, G. A. Voth, P. Salvador, J. J. Dannenberg, V. G. Zakrzewski, S. Dapprich, A. D. Daniels, M. C. Strain, O. Farkas, D. K. Malick, A. D. Rabuck, K. Raghavachari, J. B. Foresman, J. V. Ortiz, Q. Cui, A. G. Baboul, S. Clifford, J. Cioslowski, B. B. Stefanov, G. Liu, A. Liashenko, P. Piskorz, I. Komaromi, R. L. Martin, D. J. Fox, T. Keith, M. A. Al-Laham, C. Y. Peng, A. Nanayakkara, M. Challacombe, P. M. W. Gill, B. Johnson, W. Chen, M. W. Wong, C. Gonzalez, and J. A. Pople, Gaussian, Inc., Wallingford CT, 2004.
6 – V.A. Fock; J. Phys. 15: 136, 1930.
7 – W. Kohn; L. Sham; Phys. Rev. A. 140: 1133, 1965.
8 - A. D. Becke; J. Chem. Phys.; 98: 1372, 1993
9 - C. Lee; W. Yang; R. G. Parr; Phys. Rev. 37: 785, 1988.
10 - Hariharan, P.C., and Pople, J.A., Influence of polarization functions on MO hydrogenation energies, Theor. Chim. Acta, 28, 213–222 (1973).
11 - W.J. Hehre; L. Radom; P.V.R. Shleyer; J.A. Pople; Ab Initio Molecular Orbital Theory, John Wiley & Sons, 1986.
