Realizado em Teresina/PI, de 28 a 30 de Julho de 2013.
ISBN: 978-85-85905-05-7
TÍTULO: EXPERIMENTO COM MATERIAIS DE BAIXO CUSTO PARA O ENSINO DE CINÉTICA QUÍMICA: UMA PRÁTICA REALIZADA COM ALUNOS DA REDE ESTADUAL DE ENSINO DA ZONA RURAL NO MUNICÍPIO DE IRITUIA - PA
AUTORES: Moura, S.R. (UNIVERSIDADE DO ESTADO DO PARÁ) ; Ramos, G.C. (UNIVERSIDADE DO ESTADO DO PARÁ) ; Freitas, A.M.L. (UNIVERSIDADE DO ESTADO DO PARÁ) ; Silva, A.D.L. (UNIVERSIDADE DO ESTADO DO PARÁ)
RESUMO: O ensino de Química voltado para atividades práticas experimentais é um tema
bastante discutido entre os grandes estudiosos, por conduzir o aluno a adquirir
uma aprendizagem significativa. Em decorrência disso, este trabalho analisa um
procedimento metodológico de um experimento simples usando materiais de baixo
custo como comprimidos e pós efervescentes para efetivar a aprendizagem dos
conteúdos de Cinética Química, visando calcular a velocidade de decomposição
destes antiácidos. Após esse experimentos, os discentes discutiram e identificaram
que os resultados foram satisfatórios, pois fatores como a influência do aumento
de temperatura e da menor superfície de contato fez com que ocorresse a rápida
dissolução do pó.
PALAVRAS CHAVES: práticas experimentais; aprendizagem; cinética química
INTRODUÇÃO: O processo de ensino-aprendizagem dos conteúdos de Química desenvolvidos por
meio de aulas práticas experimentais permite ao aluno compreender a grande
importância de como essa ciência evoluiu e o motivo de investigá-la propicia ao
aluno a manipulação, acumulação e relacionamento com informações científicas na
discussão de fenômenos naturais que estão ao seu redor, associando a teoria à
prática (FARIAS et al, 2009, p. 2). Estudar a Cinética Química é analisar,
observar e avaliar as inúmeras reações químicas que estão ocorrendo no nosso
cotidiano sejam aquelas rápidas, lentas ou instantâneas, mas que são relevantes
ao, por exemplo, se estudar a velocidade com que as mesmas ocorrem, o que requer
uma atenção contextualizada principalmente do aluno (SALVIANO, 2007, p. 9). A
experimentação promove uma aprendizagem por investigação e descoberta,
orientando o aluno a ampliar e aprimorar o seu conhecimento científico,
desenvolver o seu potencial argumentativo e, sobretudo, fomentar uma carreira
profissional na área da educação científica e tecnológica (GONÇALVES, 2005, p.
11-39). Nesse âmbito, reforçamos a aprendizagem significativa dos conteúdos de
Cinética Química, embasados nos pressupostos da teoria de David Ausubel, que
considera que a assimilação de conhecimentos ocorre sempre de forma interativa
com outra já existente na estrutura cognitiva (TRINDADE, 2011, p. 3) e,
consequentemente, realizamos essa atividade prática experimental para que os
alunos possam discutir sua própria aprendizagem e adquiram conhecimentos
suficientes para entender os fenômenos naturais.
MATERIAL E MÉTODOS: Esta atividade foi realizada em abril de 2013, com uma turma de 2ª série do
Ensino Médio, composta por 20 alunos, da Escola Estadual de Ensino Fundamental e
Médio de Tessalônica, localizada na zona rural no município de Irituia, Estado
do Pará, após os alunos estarem providos de conhecimentos dos conteúdos
específicos de Cinética Química, visando uma análise quanti-qualitativa da
velocidade de reações químicas envolvendo comprimidos e pós efervescentes. Em um
momento inicial, o conteúdo supracitado fora ministrado, utilizando-se recursos
como data show, vídeos educativos, livro didático, bem como outras atividades e
exercícios apostilados. Depois utilizamos materiais de baixo custo para
realizarmos o experimento de modo simples, mas com grande precisão, tais como: 6
copos descartáveis transparentes, águas quente, morna e gelada, uma seringa
descartável para medir o volume de água nos copos, um termômetro graduado até
100 ºC (373 K) para verificar a temperatura da água e um cronômetro para
calcular o intervalo tempo de decomposição de 3 comprimidos e 3 pacotes de pós
efervescentes, compostos basicamente de bicarbonato de sódio (NaHCO3).
A prática experimental foi realizada na própria sala de aula, uma vez que a
escola não dispõe de laboratório de ciências e todos os materiais estavam
acessíveis. Na sequência, utilizamos volumes iguais de 0,1L de água quente (323
K), água à temperatura ambiente (300 K) e água gelada (283 K), em dois copos
para cada estado físico da água, e colocamos primeiramente o comprimido e depois
o pó, e em cada situação, averiguamos a rapidez de decomposição dos mesmos. Após
esse procedimento, um questionário foi proposto aos alunos para analisar a
efetiva percepção e a aprendizagem significativa dos mesmos.
RESULTADOS E DISCUSSÃO: Com a dissolução de cada comprimido e pó efervescentes em copos contendo água
sob diferentes temperaturas, foi possível analisar fatores como a temperatura e
a sperfície de contato que influenciam na velocidade de dissolução de antiácidos
e a produção instantânea de gás carbônico. Os dados obtidos na decomposição do
comprimido (de massa 0,004 kg) e do pó (de massa 0,005 kg) efervescentes foram
tabelados (Figura 1) para uma melhor compreensão dos dados.
A partir desses dados, os discentes conseguiam verificar que o aumento da
temperatura influenciava diretamente na velocidade de decomposição dos
antiácidos, acelerando o processo de dissolução devido ao aumento da energia
cinética média das partículas e dos choques entre as próprias moléculas e com os
copos. Outro fator que teve facilidade de percepção foi a superfície de contato,
haja vista que o pó efervescente apresenta uma área menor para que ocorra a
reação, logo de dissolve mais rapidamente que o comprimido. Portanto, a maior
velocidade de reação de decomposição ocorreu com o pó efervescente em água
quente, sob temperatura de 323 K, demorando apenas 40 segundos para se dissolver
totalmente a uma velocidade média de 1,0.10-4 kg/s de dissolução, influenciado
principalmente pela elevada temperatura e pela menor superfície de contato.
Além dos dados tabelados, os discentes construíram gráficos (Figura 2) que
relacionavam uniformemente o intervalo de tempo em função da decomposição da
quantidade de massa dos reagentes.
Figura 1
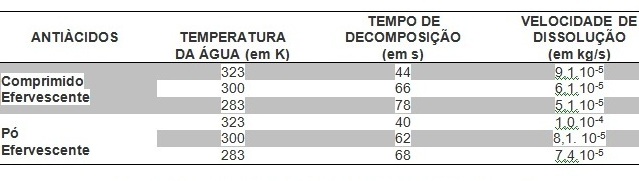
Tabela de dados das velocidades de dissolução dos
antiácidos sob diferentes temperaturas.
Figura 2
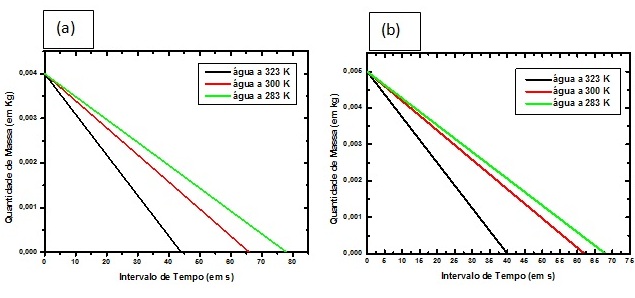
Gráficos que representam a decomposição (a) do
comprimido e (b) do pó efervescente em função do
intervalo de tempo.
CONCLUSÕES: Um ensino de Química voltado para atividades práticas através de experimentos
simples com materiais de baixo custo leva o discente a se envolver com a
disciplina, com os conteúdos estudados, adquirindo uma efetiva cognição da ciência
voltada para a aprendizagem significativa defendida por Ausubel, intrigando-o a
pesquisar os fenômenos naturais, na perspectiva de impulsioná-lo a seguir
carreiras científico-tecnológicas. Além disso, permitiu o estabelecimento de
relações entre os conhecimentos adquiridos com situações cotidianas dos alunos,
fortalecendo a concepção da aprendizagem signifiva.
AGRADECIMENTOS: A Deus, primeiramente, aos nossos familiares e amigos.
REFERÊNCIAS BIBLIOGRÁFICA: FARIAS, C. S.; BASAGLIA, A. M.; ZIMMERMANN, A. A importância das atividades experimentais no Ensino de Química. In: 1º CPEQUI – 1º Congresso Paranaense de Educação Em Química, Londrina, 23 a 26 de Novembro de 2009.
GONÇALVES, F. P. O texto de experimentação na educação em química: discursos pedagógicos e epistemológicos. Dissertação (Mestrado em Educação Científica eTecnológica), Universidade Federal de Santa Catarina, 2005.
LIMA, J. de F. L. de et al. A contextualização no ensino de cinética química. Revista Química Nova na Escola, nº 11, maio de 2000.
SALVIANO, A. B. Velocidade de Reação: uma Abordagem Investigativa. Monografia (Especialização em Ensino de Química), Universidade Federal de Minas Gerais, 2007.
TRINDADE, J. O. da. Ensino e aprendizagem do conceito de ligação química por meio de mapas conceituais. Dissertação (Mestrado Profissional em Química), Universidade Federal de São Carlos, 2011.
