Realizado em Teresina/PI, de 28 a 30 de Julho de 2013.
ISBN: 978-85-85905-05-7
TÍTULO: A POTENCIOMETRIA NA DETERMINAÇÃO DO INTERVALO DE VIRAGEM DE INDICADORES NATURAIS APLICADA AO ENSINO DE QUÍMICA
AUTORES: Moura, A.K.S. (UFPI) ; Soares, E.S. (UFPI) ; Lima, J.J.B. (UFPI) ; da Silva, R.L.G.N.P. (UFPI)
RESUMO: O trabalho teve como objetivo favorecer atratividade por uma das práticas mais
comuns à química, que é a pH-metria, mesmo porque outros instrumentos apresentam
um alto custo e algumas instituições não dispõe de recursos suficientes para
adquiri-los. Além do mais a forma usual de preparo e titulação das soluções com o
intuito apenas de observar a leitura de pH do instrumento não é em si a melhor
maneira de se explorar a técnica, dessa maneira, a proposta de determinação do
intervalo de viragem de indicadores naturais é uma forma interessante, alternativa
e viável de se aplicar os conceitos de potenciometria de uma maneira mais dinâmica
além de estar impregnada de conceitos fundamentais em Química Analítica.
PALAVRAS CHAVES: ensino; titulação; indicadores naturais
INTRODUÇÃO: Uma titulação potenciométrica é uma técnica em que as variações de pH
ocasionadas pela adição de uma quantidade de ácido ou base são medidas
instrumentalmente; o que significa que o uso de indicadores é dispensável nesse
procedimento (SKOOG et al., 2006). Contudo, devido ao controle do pH
possibilitado por esse método, a determinação da faixa de viragem de diferentes
indicadores naturais pode ser determinada com ótima precisão. Um indicador
ácido-base é uma substância cromófora, capaz de causar uma variação perceptível
na cor de uma solução quando da variação de pH, devido suas formas protonada e
desprotonada absorverem a luz de maneira diferenciada. (SKOOG et al., 2006;
TERCI & ROSSI, 2002; GOUVEIA-MATOS, 1999). Em muitos extratos naturais essa
variação é atribuída às antocianinas (BELLETTATO, 2012), que não raro alteram
sua conformação à medida que são submetidas a uma variação na concentração
hidrogeno iônica.
O trabalho consistiu em tornar a prática da potenciometria estimulante e
atrativa através da determinação dos intervalos de viragem dos extratos
etanólicos das cascas de acerola (Malpighia emarginata) e das flores e das
folhas de coração roxo (Tradescanthia pallida). Além dessas determinações foram
realizados testes qualitativos com esses e com outros extratos, como o extrato
etanólico das flores de carambola (Averrhoa carambola) e icsória (Ixora
Coccinoa) nas variedades vermelha e amarela, sendo todos os extratos adequados
também para o ensino de princípios ácido-base a um nível de ensino mais básico.
MATERIAL E MÉTODOS: O experimento foi aplicado a um grupo de alunos, cabendo à curiosidade do grupo
a escolha do material vegetal do experimento. Os extratos foram obtidos por
maceração dos materiais vegetais com etanol comercial e deixados em repouso
durante 3 a 4 dias. Os extratos foram testados qualitativamente em produtos de
uso cotidiano de caráter ácido ou básico tais como: leite, suco de limão, água
sanitária, detergente, vinagre, leite de magnésio, conserva de enlatados e
outros, bem como com ácido clorídrico e hidróxido de sódio comercial para
identificação da presença ou ausência de atividade indicadora. Ao detectar essa
atividade, o próximo passo foi a determinação da faixa de viragem de pH dos
extratos, titulando-se uma solução de hidróxido de sódio 0,1 mol L-1, contendo 1
mL dos extratos, com ácido clorídrico 0,1 mol L-1. O sistema foi mantido sob
agitação constante com o uso de um agitador magnético. As informações
significativas na mudança de pH e de cor foram então registradas pelo grupo,
procedendo-se as titulações inicialmente com a adição de 5,0 mL de titulante e
nas proximidades do ponto de equivalência com volumes de 0,25 mL para observação
mais adequada das variações de pH e coloração; o que permitiu resultados mais
contundentes no que diz respeito a mudança de coloração dos indicadores por
conta das variações de pH, além do esclarecimento do por que de alguns critérios
exigidos para que algumas substâncias sejam consideradas bons indicadores ácido-
base.
RESULTADOS E DISCUSSÃO: Como atividades requeridas pelo experimento além do intervalo de viragem, estava
também incluído a coloração de cada indicador em meio ácido e básico (Figura 1).
Os alunos observaram que todos os extratos permitiram a fácil diferenciação de
soluções ácidas e básicas, principalmente o extrato das cascas de acerola, que
apresentou cores bem distintas: laranja e verde (Figura 1); e que
qualitativamente, todos os extratos cumpriam requisitos atribuídos a bons
indicadores de pH. Frisaram que durante a aplicação dos indicadores na titulação
nem todos mostraram-se eficazes, porque alguns apresentaram uma faixa de viragem
muito longa, inviabilizando a percepção do ponto final da titulação. Antes da
adição de titulante (ácido) o pH da solução (básica) estava em torno de 12,5 e
após a adição de 50 mL de ácido, o pH atingiu um valor próximo a 1,65. Eles
puderam também prever a adequação de cada indicador a um tipo de titulação a
partir dos intervalos de viragem detectados. Como foi o caso da faixa de viragem
do indicador das cascas de acerola, flores e folhas do coração roxo e das flores
da carambola, em que o pH neutro esteve incluído dentro da faixa de viragem
sendo os extratos adequados à titulações onde o ponto de equivalência tem pH
próximo ao neutro, especialmente titulações entre ácido forte e base forte ou
ácido fraco e base fraca; e também o caso do indicador de icsória vermelha que
mesmo não apresentando uma faixa de pH adequada, foi percebido pelo grupo como
adequado a titulações como a de ácido forte com base fraca, por apresentar uma
faixa de viragem ácida. Os intervalos de viragem dos extratos testados, com
sucesso, são ilustrados na curva de titulação da Figura 2.
Figura 1
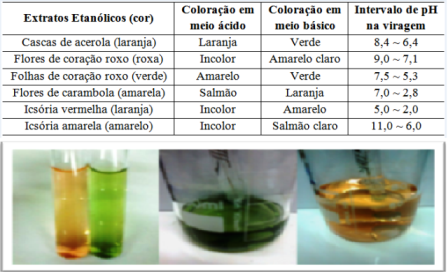
Cores exibidas pelos extratos em soluções ácidas e
básicas, e intervalos de viragem. Como exemplo é
dado o extrato das cascas de acerola.
Figura 2
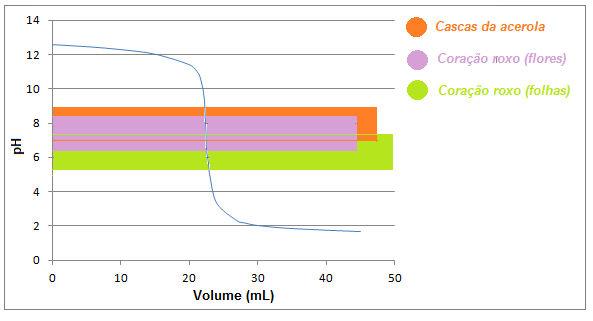
Curva de titulação ilustrando os intervalos de
viragem de alguns dos indicadores testados.
CONCLUSÕES: Pôde-se observar que durante todo o experimento o grupo se manteve atento,
aprendeu o manuseio adequado do equipamento e vivenciou vários conceitos
importantes na área de química analítica, como a variação brusca de pH na região
do ponto de equivalência devido a adição de poucos mL de ácido ou ainda a
compreensão do porque que indicadores ácido-base devem possuir um intervalo de
viragem curto. A prática é simples e ao mesmo tempo repleta de princípios
importantes para o futuro profissional, além de ser acessível a instituições que
não dispõe de infraestrutura de laboratório.
AGRADECIMENTOS: Ao Departamento de Química da Universidade Federal do Piauí (UFPI)
REFERÊNCIAS BIBLIOGRÁFICA: SKOOG, S.A.; WEST, D.M.; HOLLER, F. J.; CROUCH, S.R. Fundamentos de química analítica. 8. ed. [s.l.]: Thompson Learning, 2006.
BELLETTATO, R. D. Utilização de indicadores orgânicos de pH no ensino de ácidos e bases: considerando alguns aspectos históricos. História da Ciência e Ensino. v. 6, p.71-77, 2012.
TERCI, D. B. L; ROSSI, A. V. Indicador Natural de pH: Usar Papel ou soluções? Química Nova. v.25, n. 4, p. 684-688, 2002.
GOUVEIA-MATOS, J. A. M. Mudança nas cores dos extratos de flores e do repolho roxo. Química Nova na Escola. n. 10, p. 6-10, 1999.
