Realizado em Teresina/PI, de 28 a 30 de Julho de 2013.
ISBN: 978-85-85905-05-7
TÍTULO: DIRIGÊNCIA orto/para EM BENZENOS HALOSUBSTITUÍDOS: UMA INVESTIGAÇÃO TEÓRICA
AUTORES: Moura, L.C.B. (UFPI) ; Alencar, H.A.C. (UFPI) ; Moita Neto, J.M. (UFPI)
RESUMO: A dirigência para as posições orto/para em benzenos halosubstituídos foi
estudada teoricamente empregando métodos de cálculo semi-empírico. O objetivo foi
mostrar a tendência dos halogênios em compostos aromáticos como orientadores
orto/para em reações de substituição eletrofílica. Parâmetros de cargas
foram analisados a fim de correlacioná-los com a possível dirigência. Os valores
encontrados de carga confirmaram a dirigência orto/para dos substituintes
flúor e cloro. Para bromo e iodo os valores encontrados de carga não apresentaram
diferenças significativas ao ponto de serem confirmadas as posições
orto/para como sendo a dirigência desses substituintes.
PALAVRAS CHAVES: cáculo semi-empírico; halosubstituintes; orto/para dirigência
INTRODUÇÃO: Os eletrófilos são íons positivos (E+) ou alguma outra espécie
deficiente em elétrons com uma carga parcial positiva grande. Esses íons atacam
o anel benzênico, substituindo um dos átomos de hidrogênio em uma reação chamada
de substituição aromática eletrofílica, que permite a introdução direta de uma
grande variedade de grupos em um anel aromático, fornece rotas sintéticas para
muitos compostos importantes (SOLOMONS e FRYHLE, 2009).
Alguns substituintes tornam o anel mais reativo e alguns o tornam menos reativos
que o benzeno diante da substituição eletrofílica em aromáticos. Os
substituintes ativantes tornam o anel benzênico mais reativo diante da
substituição eletrofílica, doam elétrons ao anel por ressonância e retiram
elétrons do anel indutivamente. Os substituintes desativantes tornam o anel
benzênico menos reativo diante da substituição eletrofílica. Os halogênios são
substituintes fracamente desativantes, doam elétrons por ressonância e retiram
elétrons do anel indutivamente, sendo que eles retiram elétrons por indução mais
fortemente do que doam elétrons por ressonância (BRUICE, 2006).
A criação de programas computacionais permitiu a compreensão da química de forma
mais profunda, os métodos computacionais obtêm valores aproximados da equação de
Schrödinger. Pode-se dar ênfase aos métodos ab initio que se baseiam em
procedimentos de Hartree-Fock (HF) e na Teoria do Funcional de Densidade (DFT);
e métodos semi-empíricos (que fazem uso de aproximações e dados experimentais na
resolução da equação de Schrödinger).
O objetivo deste trabalho foi mostrar, através de cálculos teóricos, a
tendência dos halogênios (substituintes fracamente desativantes) em benzenos
halosubstituídos como orientadores orto/para em reações de substituição
eletrofílica.
MATERIAL E MÉTODOS: Cálculos computacionais foram realizados para os benzenos halosubstituídos
(Fluorobenzeno, Clorobenzeno, Bromobenzeno, Iodobenzeno). A análise mecânico-
quântica foi realizada utilizando o pacote computacional Gaussian 03W (FRISCH et
al., 2003).
Utilizou-se método semi-empírico com o conjunto de base PM3 para análise de cargas
atômicas dos benzenos substituídos. O software GaussView 3.0 foi utilizado para
gerar os inputs necessários para realização dos cálculos e para visualização dos
resultados obtidos.
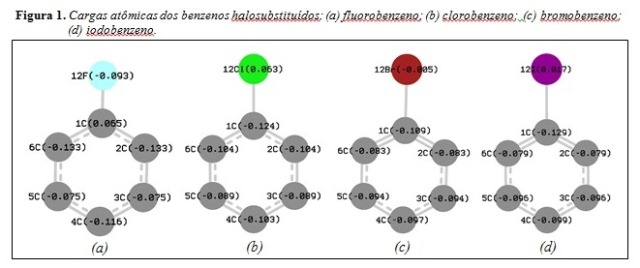
RESULTADOS E DISCUSSÃO: A Figura 1 mostra os valores de cargas atômicas para os átomos de carbono e
halogênios dos benzenos halosubstituídos.
O efeito dirigente de um substituinte está relacionado aos efeitos indutivos e
de ressonância. No benzeno o átomo de hidrogênio serve de referência a esses
efeitos por ser o único substituinte na molécula. O efeito indutivo é uma
consequência da eletronegatividade do halosubstituinte que atrai os elétrons
para si fazendo com que o anel benzênico fique menos reativo. Por outro lado, no
efeito de ressonância há doação de elétrons para o anel benzênico, tornando-o
mais reativo.
Como os halogênios são substituintes fracamente desativantes (retiram elétrons
indutivamente de forma mais pronunciada que a doação de elétrons por
ressonância), era de se esperar que esses substituintes provocassem na
substituição eletrofílica uma orientação na posição meta do anel
benzênico. Entretanto, os halogênios são grupos orientadores orto/para
mesmo sendo grupos desativantes.
Os resultados observados na Figura 1 confirmam a dirigência orto/para dos
grupos ligados ao anel aromático de acordo com as cargas atômicas obtidas
através de cálculos teóricos. Nas Figuras 1(a) e 1(b) os maiores valores de
carga negativa nos carbonos 2, 4, e 6 indicam a dirigência a essas posições no
ataque eletrofílico. Nas Figuras 1(c) e 1(d), os valores de carga dos carbonos
2, 3, 4, 5 e 6 (possíveis de serem atacados) não apresentaram diferenças
significativas para a afirmação da substituição ocorrer nas posições
orto/para e não na posição meta. Entretanto, como bromo e iodo
possuem, respectivamente, orbitais 4p e 5p, estes não possuem boa sobreposição
ao orbital 2p do carbono em comparação com os orbitais do flúor e cloro (2p e
3p, respectivamente).
CONCLUSÕES: Os valores de carga obtidos confirmaram a dirigência dos substituintes flúor e
cloro para as posições orto/para do benzeno substituído. A não
significância das diferenças de carga dos substituintes bromo e iodo impedem que
se faça afirmação da posição em que esses substituintes possam orientar. A análise
mecânico-quântica mostrou-se ser uma ferramenta útil na análise das cargas para
determinação da orientação orto/para de halosubstituintes. Cálculos teóricos com
maior grau de rigor podem ser realizados para investigação mais precisa quanto à
orientação dos substituintes bromo e iodo.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: BRUICE, P.Y. [i]Química Orgânica[/i]. 4. ed. São Paulo: Pearson Prentice Hall, 2006.
FRISCH, M. J.; TRUCKS, G. W.; SCHLEGEL, H. B.; SCUSERIA, G. E.; ROBB, M. A.; CHEESEMAN, J. R.; MONTGOMERY, JR., J. A.; VREVEN, T.; N. KUDIN, K.; BURANT, J. C.; MILLAM, J. M.; IYENGAR, S. S.; TOMASI, J.; BARONE, V.; MENNUCCI, B.; COSSI, M.; SCALMANI, G.; REGA, N.; PETERSSON, G. A.; NAKATSUJI, H.; HADA, M.; EHARA, M.; TOYOTA, K.; FUKUDA, R.; HASEGAWA, J.; ISHIDA, M.; NAKAJIMA, T.; HONDA, Y.; KITAO, O.; NAKAI, H.; KLENE, M.; LI, X.; KNOX, J. E.; HRATCHIAN, H. P.; CROSS, J. B.; ADAMO C.; JARAMILLO, J.; GOMPERTS, R.; STRATMANN, R. E.; YAZYEV, O.; AUSTIN, A. J.; CAMMI, R.; POMELLI, C.; OCHTERSKI, J. W.; AYALA, P. Y.; MOROKUMA, K.; VOTH, G. A.; SALVADOR, P.; DANNENBERG, J. J.; ZAKRZEWSKI, V. G.; DAPPRICH, S.; DANIELS, A. D.; STRAIN, M. C.; FARKAS, O.; MALICK, D. K.; RABUCK, A. D.; RAGHAVACHARI, K.; FORESMAN, J. B.; ORTIZ, J. V.; CUI, Q.; BABOUL, A. G.; CLIFFORD, S.; CIOSLOWSKI, J.; STEFANOV, B. B.; LIU, G.; LIASHENKO, A.; PISKORZ, P.; KOMAROMI, I.; MARTIN, R. L.; FOX, D. J.; KEITH, T.; AL-LAHAM, M. A.; PENG, C. Y.; NANAYAKKARA, A.; CHALLACOMBE, M.; GILL, P. M. W.; JOHNSON, B.; CHEN, W.; WONG, M. W.; GONZALEZ C.; POPLE, J. A.; [i]Gaussian 03W; Gaussian, Inc., Pittsburgh PA[/i], 2003.
SOLOMONS, T. W. G. e FRYHLE, C. B. [i]Química Orgânica[/i]. v. 1. 9. ed. Rio de Janeiro: LTC, 2009.
