Autores
Silva, T.T. (IFPI) ; Coêlho, R.C. (IFPI) ; Andrade, Y.B. (IFPI) ; Nunes, M.F.D. (IFPI) ; Santos, M.C. (IFPI) ; Chagas, L.R.B. (IFPI) ; Oliveira, M.D.A. (IFPI) ; Carvalho, T.N.F. (IFPI) ; Nascimento, L.M.L. (IFPI)
Resumo
Estabelecer relações do cotidiano com o ensino de química é importante, pois mostra que a química não é abstrata e está intimamente ligada ao dia-a-dia do aluno. A água sanitária, conhecida também como alvejante é uma solução diluída de hipoclorito de sódio (NaOCl), que é muito usada pela população principalmente na limpeza. Este trabalho é parte de um conjunto de experimentos laboratoriais da disciplina de química analítica, e este teve como objetivo a identificação do pH e do teor de cloro ativo em alvejantes vendidos em Teresina-PI, por titulação iodométrica. Realizaram-se duas titulações, com intervalo de nove dias. Contudo constatou-se que algumas marcas não estavam dentro dos padrões em relação ao teor de cloro ativo, e dentro do padrão em relação ao pH.
Palavras chaves
alvejantes; cotidiano; quimica analitica
Introdução
A água sanitária comercial é uma solução diluída de hipoclorito de sódio, essa solução é obtida ao se passar gás cloro por uma solução concentrada de hidróxido de sódio de acordo com a seguinte reação (CARBOCLORO, 2014): 2NaOH + Cl2 → NaOCl + NaCl + H2O A legislação define que o teor de cloro ativo na água sanitária comercial deve atender o intervalo entre 2,0 a 2,5 % p/p durante o prazo de validade (máximo de 6 meses. Entretanto, para fins de fiscalização, a ANVISA considera um intervalo de aceitação entre 1,75 e 2,75 % p/p (RDC nº 184/2001) (Portaria n° 89/1994, ANVISA).Uma quantidade acima do permitido significa mais quantidade de cloro que pode ser liberado em forma de gás podendo ser absorvido pelo corpo humano através da respiração (BRASIL, 2014).As águas sanitárias são produtos alcalinos, logo possuem valores de pH próximos de 14.Mas esses valores devem ser limitados para não causar queimaduras, seja pelo contato direto com a pele ou com os olhos (BRASIL, 2014). A legislação define que o pH máximo do produto puro deverá ser de 13,5 e, do produto diluído a 1% (p/p) de 11,5 (Portaria n° 89/1994, ANVISA). Em alguns cursos de química, há a divisão da disciplina de Química Analítica em duas partes: teórica e experimental, onde a primeira visa desenvolver a compreensão dos princípios teóricos básicos, e a segunda, uma implementação de análises quantitativas baseadas em medidas gravimétricas e titulométricas. Com isso, dentre o conjunto de assuntos tratados pela química analítica, este trabalho dará destaque a volumetria de óxido-redução. A volumetria de óxido- redução baseia-se em reações de oxirredução entre o analito e titulante, que pode ser aplicada para determinação de diversos analitos em química, biologia, ciências do meio ambiente e de materiais(HARRIS, 2001).
Material e métodos
Primeiramente fez-se um breve levantamento teórico sobre o tema do trabalho, em seguida foram selecionadas 08 marcas de água sanitária vendidas no mercado de Teresina-PI, algumas consideradas líderes de mercado, e outras de menor participação, fabricadas por empresas de médio e pequeno porte. As amostras selecionadas foram levadas ao laboratório de química do Instituto Federal de Educação, Ciência e Tecnologia do Piauí- IFPI, e mantiveram lacradas até o inicio das análises. Após o preparo das soluções (solução de amido a 1% (m/v); solução de tiossulfato de sódio 0,1 mol L-1; solução padrão de iodato de potássio); deu-se início ao primeiro procedimento da analise que é a padronização do tiossulfato de sódio, em seguida realizou-se a determinação iodométrica do cloro-ativo nos alvejantes comerciais, realizadas em triplicatas e calculou-se o teor percentual de cloro-ativo em cada uma das amostras, foram feitas duas titulações, a segunda após nove dias, para analisar o quanto o teor de cloro ativo tinha diminuído. O pH foi determinado através de um pHmetro digital. Os resultados foram comparados com a legislação (Portaria n° 89/1994, ANVISA) e esclarecidos em um relatório feito por cada aluno.
Resultado e discussão
Foram realizadas duas determinações iodométrica de cloro-ativo com um intervalo
de nove dias. A imagem abaixo mostra os valores do teor de cloro ativo e o
desvio de cada marca na primeira e segunda titulação e valor do pH encontrado.
Na primeira titulação as marcas B, C, F, G e H foram consideradas não conformes,
pois apresentaram valores acima do permitido pela ANVISA e a marca G valor
abaixo.
Constatou-se na segunda titulação que o teor de cloro de algumas marcas aumentou
e outras diminuíram. Foram consideradas não conformes na segunda titulação as
marcas A, C, E, F e G. Observou-se que as marcas A, E e G obtiveram um aumento
do teor de cloro ativo, já nas marcas C e F o teor de cloro ativo diminuiu. A
diminuição do teor de cloro ativo pode ter sido ocasionada pela a temperatura e
devido às embalagens já terem sido abertas. Deve-se considerar também a forma
como é feito a armazenagem e tempo de estoque dos alvejantes, levando a redução
do teor de cloro ativo. Podem ser considerados também à instabilidade da solução
de amido.
Para análise do pH utilizou-se um pHmetro digital. Para esta análise todas as
marcar apresentaram valores abaixo do permitido pela legislação, que é um pH
máximo de 13,5.
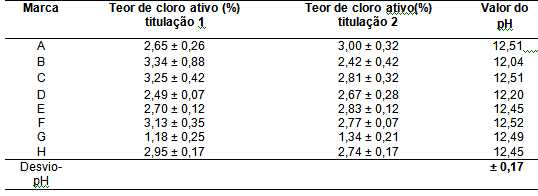
Imagem 1. Resultados dos valores do teor de cloro ativo dos alvejantes na primeira e segunda titulação e do pH.
Conclusões
O trabalho determinou os parâmetros pH e teor do cloro ativo. Para o pH os alvejantes estão de acordo com o exigido na legislação. Entretanto para o teor de cloro ativo cinco marcas não estão conformes, assim percebeu-se que nem todos os produtos seguem os padrões exigidos pela legislação. Com base nas experiências e observações dos alunos na aula prática concluiu-se que o experimento, faz uma ligação entre o cotidiano do aluno e o ensino de química analítica para a volumetria de óxido-redução, sendo uma prática adequada para o ensino de oxirredução aplicada à química analítica.
Agradecimentos
Instituto Federal de Educação, Ciência e Tecnologia do Piauí-IFPI.
Referências
BRASIL. Instituto Nacional de Metrologia (INMETRO). Água Sanitária– Produto e Segurança da Embalagem. Disponível em <http://www.inmetro.gov.br/consumidor/produtos/agua_sanitaria2.asp>. Acesso em: 30 jan. 2014.
BRASIL. Decreto n.º 89, de 25 de agosto de 1994.
BACCAN, N. et al. Química Analítica Quantitativa Elementar. 3ª ed., Editora Edgar Blucher, São Paulo, 2004.
CARBOCLORO. Aprenda a utilizar o Hipoclorito de Sódio (HIPO) de maneira correta. Disponível em: <http://www.carbocloro.com.br/produtos/hipo/hipo1.htm>. Acesso em: 30 jan. 2014.
Harris, D. C. Análise Química Quantitativa, 6ª edição, Rio de Janeiro: LTC, 2001.
SKOOG, D.A. et al. Fundamentos de química analítica. 8ª ed. São Paulo: Pioneira Thompson Learning, 2007.
VOGEL, et al. Análise química quantitativa. 6ª Ed. Rio de Janeiro: LTC, 2008.

