Autores
Assis, S. (INSTITUTO FEDERAL DE ALAGOAS) ; Bernardes, E. (INSTITUTO FEDERAL DE ALAGOAS)
Resumo
A flor conhecida como papoula (Hibiscus sp.) é uma espécie que possui um pigmento advindo das antocianinas. Esse pigmento geralmente apresenta propriedades que em pHs diferentes muda de coloração. O objetivo desse trabalho é conhecer as propriedades desse pigmento extraído de pétalas de Hibiscus sp. de modo a testar o indicador em um gradiente de pH com soluções padrões de NaOH e HCl para conhecer as colorações e comparar com uma sequência de soluções de baixo custo encontradas no dia a dia. O indicador mostrou mudanças significativas na coloração ao longo da modificação de pH, o que nos confere um bom indicador ácido-base. Como as soluções usadas tratam-se de substâncias do cotidiano, torna ainda mais acessível e didática uma aula prática.
Palavras chaves
aula demonstrativa ; indicador natural; ácidos e bases
Introdução
Um indicador de pH, também chamado indicador ácido-base, é um composto químico que é adicionado em pequenas quantidades a uma solução, permitindo conhecer se a solução é ácida, básica ou neutra. Estes corantes são dotados de propriedades halocrômicas, que é a capacidade de mudar de coloração em função do pH do meio. Frequentemente são ácidos ou bases fracas e quando adicionados a uma solução, ligam-se aos íons H+ ou OH-. A ligação a estes íons provoca uma alteração da configuração eletrônica destes indicadores e, consequentemente, altera-lhes a cor (LIMA, 2013).Um corante natural é uma substância corada extraída apenas por processos físico-químicos (dissolução, precipitação, entre outros) ou bioquímicos (fermentação) de uma matéria-prima viva. Esta substância deve ser solúvel no meio líquido onde vai ser mergulhado o material a tingir. São bastante utilizados em laboratórios didáticos, quando objetiva-se estimar o pH de uma solução desconhecida(ARAÚJO, 2005). No caso dos indicadores naturais, trata-se quimicamente, das antocianinas que são glicosídeos das antocianidinas, cujo núcleo básico é o cátion flavilium. (VOLP et al., 2008). São compostos responsáveis por uma variedade de cores atrativas de frutas, flores e folhas que variam do vermelho alaranjado, como no morango (Fragaria vesca L.) ao roxo, no jambolão (Syzygium jambolanum(L.) Skeels), passando pelo vermelho vivo, na Papoula (Hibiscus sp.)(VOLP et al., 2008). O objetivo desse trabalho é conhecer as propriedades desse pigmento extraído de pétalas de Hibiscus sp. de modo a testar o indicador em um gradiente de pH com soluções padrões de NaOH e HCl para conhecer as colorações e comparar com uma sequência de soluções de baixo custo encontradas no dia a dia.
Material e métodos
Para a extração do pigmento da flor Papoula (Hibiscus sp.) foram utilizadas 7,5 g de pétalas de flor (8 flores) e com o auxílio de um almofariz e pistilo macerou-se em 50 mL de álcool 70º (concentração aproximada de 1:6) segundo método descrita por Dias,Guimarães e Merçon (2003).Para o teste do extrato da flor como indicador foi preparada uma sequência de pH a partir de soluções preparadas de NaOH e HCl para poder conhecer as colorações e comparar com a sequência de pH de materiais encontrados no dia a dia como (suco de limão, vinagre, água oxigenada, cerveja, suco de laranja, leite, água, creme dental, sabonete para mãos, hipoclorito de sódio e água sanitária.
Resultado e discussão
O extrato da flor Hibiscus sp apresentou a coloração vinho. Foram observadas
mudanças de coloração bem distintas nas soluções de pHs ácidos e básicos, o que
nos confere bons indicadores de pH (Tabela 01 ), assim como obtiveram coloração
igual ou semelhante aos resultados propostos por Santos et al. (2012) que
observaram que as soluções apresentaram colorações bem próximas de vermelho em
meio ácido, e próximo de verde em básico(Figura 01 A).
A mudança de incolor para verde na base (NaOH), é indicativo da presença de
clorofila na constituição dos pigmentos, uma vez que esta, em meios básicos,
muda a coloração do meio para verde. A coloração avermelhada e tonalidades
próximas na escala de cor, em substâncias ácidas, indica a presença de
antocianinas. As antocianinas possuem coloração avermelhada em meio ácido,
violeta em meio neutro e azul em condições alcalinas (TERCI, 2002).
Comprovou-se a eficácia do indicador em soluções padrão ácida, básica e salina
de concentrações conhecidas e nas soluções que encontramos no dia a dia (suco de
limão, vinagre etc.) (Figura 01B).Como as soluções usadas tratam-se de
substâncias do cotidiano, tornam-se ainda mais acessível e didática a aula
prática.
Com a falta de laboratório de ciências bem equipado nas escolas, algumas
modificações podem ser feitas para deixar a aula adequada a realidade da escola,
como trocar pipetas por conta-gotas, soluções de NaOH e HCl por materiais que
podem ser encontrados no dia a dia do aluno e professor. Outro aspecto
importante é a biodiversidade de cada região do país, podendo-se também
substituir a flor de Hibiscus sp.a alguma flor ou fruto local que possua
antocianina, ou seja, possua coloração, o que traria semelhantes resultados
vendo que também irá ser obtida a mudança a coloração.
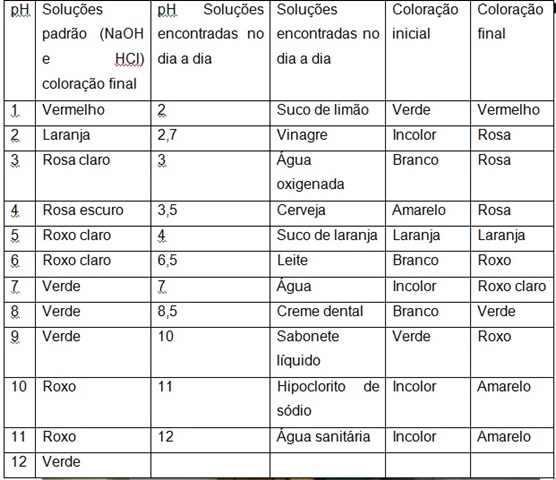
Tabela 01 -Mudança de coloração nas soluções padrão de pHs ácidos, básicos e neutros e nas soluções encontradas no dia a dia.

Sequência de pH de 1 a 12 a partir das soluções padrão feitas com HCl e NaOH (A).Variação de pH a partir dos materiais encontrados no dia a dia (B)
Conclusões
O extrato da flor (Hibiscus sp.)mostrou-se um bom indicador, diferenciando-se de forma nítida as mudanças de coloração em pHs distintos. Além de ser de fácil obtenção e extração,pode também se utilizado como recurso didático para aulas demonstrativas de química, utilizando-se dos materiais mais diversos encontrados no dia a dia que viabilizam tais atividades.
Agradecimentos
Referências
ARAUJO, M. E. M. Corantes naturais para têxteis – da antiguidade aos tempos modernos. Texto de apoio DQB, FCUL, 30p, 2005
DIAS, M. V.; GUIMARÃES, C. I. P.; MERÇON, F. Corantes Naturais: Extração e emprego como indicadores de pH. Química Nova na Escola. Niterói, n. 17, p.27-31, 2003.
LIMA, R. Escala de pH e indicadores ácido-base naturais. Disponível em: < http://pontociencia.org.br/experimentosinterna.php?experimento=1158&ESCALA+DE+PH+E+%20INDICADORES+ACIDOBASE+NATURAIS#top > Acesso em: 7 Jun 2014.
SANTOS, V. G. L. ; RODRIGUES, B. L. ; LIMA, G. P. ; SOUSA, O. T.; NETO, C. G. J. J. ; CHAVES, C. D. Indicadores naturais ácido-base a partir de extração alcoólica dos pigmentos das flores Hibiscus rosa-sinensis e Iroxa chinensi, utilizando materiais alternativos, Disponível em < http://propi.ifto.edu.br/ocs/index.php/connepi/vii/paper/viewFile/1352/1154> Acesso em 08 Jul 2014
TERCI, D. B. L.; ROSSI, V. A. Indicadores naturais de pH: Usar papel ou solução? Quim. Nova, n. 4, p.684-688, 2002. Disponível em: <http://www.scielo.br/pdf/qn/v25n4/10546.pdf>. Acesso em: 06 Jul 2014.
VOLP, A. C. P.; RENHE, I. R. P.; BARRA, K.; STRINGUETA, P. C. Flavonóides antocianinas: características e propriedades na nutrição e saúde. Revista Brasileira de Nutrição Clínica ;23, p. 141-149, 2008.

