Autores
Borges, D.K.G. (UFAM) ; Souza, K.S. (UFAM)
Resumo
O vinagre é um produto consumido em nossas casas, portanto faz parte do cotidiano do aluno. O objetivo deste trabalho é usar a experimentação no ensino de química, associando os conceitos químicos (ácido, base, densidade) de forma contextualizada, através da promoção de um ambiente de observação e discussão desenvolvendo o raciocínio lógico e pensamento crítico nos alunos para a apreensão do conhecimento químico e postura como cidadão. Foi realizado na Escola Estadual Inspetora Dulcinéia Varela Moura e exposto na II Mostra de Bioexatas. Foram selecionadas duas marcas de vinagre de forma aleatória. A turma foi dividida em quatro equipes. O vinagre foi titulado com solução de NaOH e os alunos puderam observar que as amostras encontram- se dentro das especificações da legislação brasileira.
Palavras chaves
conceitos químicos; experimentação; vinagre
Introdução
A palavra vinagre é oriunda do idioma Francês e significa “vinho agre” ou “vinho azedo”, ainda que ele não seja obtido apenas do vinho, mas também de outras matérias primas, como algumas frutas (OLIVEIRA et al., 1987). O vinagre vem sendo utilizado ao longo da história como condimento e conservante de alimentos (ABUD et al, 2012), além de possuir propriedades nutritivas e biorregulatórias consideradas como complementos indispensáveis à alimentação do homem. A experimentação no ensino de química é tema constante nas escolas, entre professores, em congressos e em revistas da área, seja por sua contribuição para o processo de ensino e aprendizagem ou pelas dificuldades encontradas para sua aplicação e desenvolvimento (SANTANA, 2014). Porém, mesmo após a publicação de vários documentos do Ministério e Secretarias de Educação, como LDB, PCNEM, persiste um número enorme de conteúdos na maioria dos livros didáticos, que pode resultar em uma aprendizagem pouco duradoura. Essa situação não permite ao aluno participar da construção de um entendimento mais profundo e útil sobre o mundo natural e cultural, como preconiza a LDB (RUBINGER; BRAATHEN, 2012). Para que essas aulas práticas possam acontecer, o professor precisa apresentar motivação, planejamento e conhecimento. Com situações simples do cotidiano dos alunos, os professores podem despertar nos alunos um maior interesse em aprender química ao mesmo tempo que conhece suas concepções para iniciar uma discussão, de forma que os alunos possam propor solução ao problema investigado, assim estarão exercitando o raciocínio e a cidadania (CASTELEINS, 2011; SANTANA, 2014). Em virtude de tudo que foi apresentado o objetivo deste trabalho é analisar o teor de ácido acético no vinagre comercial e assim trabalhar os conceitos químico.
Material e métodos
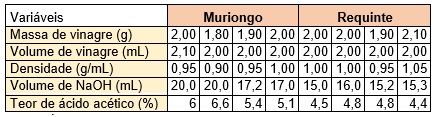
Esta atividade foi realizada em turma do primeiro ano, com 20 alunos da Escola Estadual Inspetora Dulcineia Varela Moura, e apresentado na II Mostra de Bioexatas da referida escola, no mês de junho de 2017. Primeiramente foi selecionado duas marcas de vinagre escolhido aleatoriamente: (Muriongo e Requinte) ambos vinagre de álcool. A turma foi dividida em quatro equipes, duas equipes analisaram o vinagre Muriongo e duas equipes analisaram o vinagre Requinte. Cada equipe repetiu duas vezes a mesma análise. Foi medido 2 mL de vinagre em uma pipeta e pesado na balança para saber sua massa, para assim calcularmos a densidade do vinagre. Posteriormente colocamos 2 gotas de fenolftaleína e iniciamos a titulação com solução de NaOH 0,1 mol/L. O processo de titulação implica em gotejar o titulante no erlenmeyer que contém o titulado e o indicador de ácido-base, ao mesmo tempo realiza-se movimentos circulares com o erlenmeyer, até que atinja o ponto de equivalência (viragem de cor). Só então interrompe-se o gotejamento do titulante. O ponto final, utilizando o indicador fenolftaleína, ocorre no intervalo de pH 8,3-10,0. A titulação foi realizada duplicata para maior confiabilidade dos resultados.
Resultado e discussão
Os valores de referência para densidade do vinagre de acordo com a instrução
normativa n. 6 do Ministério da Agricultura, Pecuária e Abastecimento (MAPA,
2012) estão entre 1009,4 e 1010,7, ou seja, os dados obtidos e apresentados
na tabela 1, estão entre 0,9 – 1,05 g/mL e considerando fins didáticos,
encontram-se dentro dos parâmetros apresentados pela legislação. Deve-se
aqui considerar a precisão dos aparelhos medidos e inexperiência dos
operadores (alunos).
O vinagre contém ácido acético como seu principal constituinte ácido. A
determinação da concentração deste ácido é feita por titulação com solução
de NaOH (hidróxido de sódio), o processo de titulação é descrito pela
reação: C2H4O2 + NaOH → NaC2H3O2 + H2O. Vale ressaltar que a solução de NaOH
precisaria ser padronizada, mas como não tínhamos o material necessário, não
foi realizada. Portanto os resultados apresentados tem fins didáticos, não
podendo afirmar que está dentro ou não das especificações. Os resultados da
titulação com solução de NaOH encontra-se na tabela 1, bem como os
resultados do teor de ácido acético no vinagre, que foi calculado da
seguinte maneira:
teor do ácido acético% = [ V x C x 60 x 100 /( massa de vinagre x 1000 )]
onde: V = volume da solução de NaOH;
C= concentração da solução de NaOH;
Logo, o teor do ácido acético na amostra de vinagre da marca Muriongo variou
de 5,1-6,6 % e da marca requinte variou de 4,4 - 4.8 %. Ambos encontrando-se
dentro das especificações da legislação Brasileira que estabelece 4 % como
teor mínimo de ácido acético em vinagre comercial. Embora apenas a marca
Requinte condiz com o rótulo do produto analisado indicando 4 %.
Conclusões
A experimentação permitiu aos alunos estudar umas das propriedades das substâncias, a densidade, bem como ter noção de como um consumidor deve agir para não ser enganado. Eles puderam verificar como as agências reguladoras agem para testar os produtos e viram que o vinagre analisado estava dentro das especificações de qualidade, pois o teor obtido está entre 4 a 6%, corroborando com o padrão estabelecido pela legislação. Houve a participação ativa dos alunos durante a experimentação e ao final puderam compartilhar o conhecimento adquirido com professores e alunos da escola durante a mostra.
Agradecimentos
SEDUC AM, Gestor Ivan Rufino, Escola Estadual Inspetora Dulcineia Varela Moura, representada por todos os servidores e alunos.
Referências
ABUD, A. K. S.; SILVA, C. E. F.; ARAÚJO, L. T. Produção de vinagre de laranja “lima” em vinagreira artesanal. Scientia Plena, Aracaju, v. 8, n. 12, 2012.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa nº 6, de 03 de abril de 2012. Brasília, 2012.
CASTELEINS, V. L. Dificuldades e benefícios que o docente encontra ao realizar aulas práticas de química. In: CONGRESSO NACIONAL DE EDUCAÇÃO – EDUCERE, 10., 2011, Curitiba. Anais eletrônicos. Disponível em: <http://educere.bruc.com.br/CD2011/pdf/6331_3949.pdf>.
OLIVEIRA, J. A. P. et al. Produção de vinagre de álcool à partir de frutos tropicais excedentes da safra. B. CEPPA, Curitiba, v. 5, n. 1, p. 33-40, 1987.
RUBINGER, M. M. M.; BRAATHEN, P. C. Ação e reação: ideia para aulas especiais de química. Belo Horizonte, 2012.
SANTANA, E.; SILVA, E. (Org.). Tópicos em Ensino de Química. São Carlos: Pedro & João Editores, 2014.

