Autores
Silveira, M.M.S. (UFTM) ; Bernardes, G.S. (UFTM) ; Lima, R.H. (UFTM) ; Alves, V.A. (UFTM) ; Silva, L.A. (UFTM)
Resumo
A proposta aborda a experimentação eletroquímica como ferramenta pedagógica para o envolvimento integral e dinâmico do aluno, facilitando o processo de ensino-aprendizagem. O foco do trabalho é a geração do hidrogênio utilizando materiais alternativos e de fácil acesso, explorando as semirreações eletroquímicas não espontâneas que acontecem no ânodo e cátodo. Para facilitar a identificação da reação anódica e catódica, e o acompanhamento da decomposição eletroquímica da água, utilizou-se extrato de feijão preto como indicador alternativo. Geração de hidrogênio é ponto crucial para o desenvolvimento da tecnologia da célula a combustível. O experimento corrobora com a elucidação de formas alternativas para a geração de energia elétrica para atender as necessidades atuais da sociedade moderna
Palavras chaves
Ensino de química; Eletrólise da água; Semirreações eletródicas
Introdução
O hidrogênio é considerado o elemento químico mais simples da tabela periódica, condição fundamental na comprovação de teorias atômicas. Estimativas indicam que o hidrogênio é o elemento químico mais abundante no universo, mas representa apenas 0,9% da massa de nosso planeta. O primeiro relato sobre a preparação do hidrogênio aconteceu no século XVI, Paracelsus reagiu ácidos com alguns metais. O experimento foi repetido por Robert Boyle e depois por Nicolas Lémery, que relatou a inflamabilidade do gás. Somente em 1766 é que Henry Cavendish distinguiu o hidrogênio de outros gases inflamáveis. Em 1781 Antoine-Laurent de Lavoisier chamou-o de hidrogênio (formador de água) (PEIXOTO, p. 1, 1995). As características descobertas do hidrogênio, baixíssima densidade e altamente inflamável, foram evidenciadas no acidente do dirigível Zeppelin em 1937. A preparação industrial mais comum de hidrogênio é o processo catalítico de reforma a vapor de hidrocarbonetos, mas também pode ser preparado por processos eletrolíticos, fotocatalítico e termoquímico. O hidrogênio combinado com nitrogênio (amônia) é importância na fabricação de fertilizantes. O hidrogênio também é muito utilizado na reação de hidrogenação de óleos insaturados usados na fabricação de margarinas e sabões. O processo eletrolítico é dispendioso porque necessita de grandes quantidades de energia elétrica e são conduzidos em meio ácido, neutro ou básico. O objetivo desse trabalho é disponibilizar um experimento simples com materiais alternativos e de fácil acesso, para facilitar o acompanhamento e o entendimento das semirreações eletródicas não espontâneas que acontecem no ânodo e cátodo. Usar a eletrólise da água para tratar o tema eletroquímica incentiva alunos do ensino médio ou da graduação para o estudo e a pesquisa
Material e métodos
O gerador de hidrogênio foi construído com duas chapas de aço inox, uma para o cátodo e a outra para o ânodo, encaixadas e seladas em seringas de 60 mL, sem os êmbolos, e invertidas em recipientes de plástico transparente de 500 mL contendo uma solução de ácido sulfúrico 0,5 mol/L, constituindo a célula eletrolítica. Utilizou-se dois pequenos pedaços de fio de cobre para fazer o contato elétrico com as chapas de aço inox. Outras duas seringas com escalpes foram conectadas às seringas da célula eletrolítica para realizar o preenchimento completo com a solução eletrolítica e, no final da eletrólise da água, para aspiração dos gases hidrogênio e oxigênio. Uma fonte elétrica de celular foi reaproveitada para prover energia elétrica para a eletrólise da água. Após montagem da célula eletrolítica, deve-se conectar o polo negativo da fonte elétrica no cátodo (gerador de gás hidrogênio) e o polo positivo da fonte elétrica no ânodo (gerador de gás oxigênio). Para facilitar a identificação do cátodo e do ânodo da célula eletrolítica, utilizou-se o extrato de feijão preto. Antes de iniciar a eletrólise da água, a solução de ácido sulfúrico apresentou coloração vermelha. A solução permaneceu vermelha no interior da seringa contendo o cátodo; na seringa contendo o ânodo a solução alterou para a cor amarela. A identificação do cátodo e do ânodo também foi acompanhada por meio das proporções dos gases gerados, facilitando o entendimento das reações eletródicas.
Resultado e discussão
Considerando a geração dos gases hidrogênio e oxigênio numa célula
eletrolítica, o processo ocorre por meio da transformação de energia
elétrica em energia química. Considerando as atuais fontes de produção e
transmissão de eletricidade, manter o funcionamento de uma célula
eletrolítica torna o processo extremamente dispendioso. Espera-se que o
aperfeiçoamento das tecnologias de fontes energéticas renováveis, eólicas e
solares, permita promover a produção industrial do hidrogênio em células
eletrolíticas, com impacto ambiental muito inferior ao processo de reforma a
vapor de combustíveis fósseis. A aplicação de um sobrepotencial acima de
+1,23 V nos eletrodos imersos na solução eletrolítica provocou a
decomposição eletroquímica da água, figura 1. No polo negativo (cátodo)
aconteceu o desprendimento do gás hidrogênio e no polo positivo (ânodo)
aconteceu o desprendimento do gás oxigênio (TICIANELLI et al., p. 192,
1998). A reação de decomposição da água foi acompanhada pela formação de
bolhas dos gases nas superfícies dos eletrodos de aço inox e alteração da
cor do indicador alternativo extraído do feijão preto. As semirreações
eletródicas foram consideradas no cálculo do potencial padrão da célula
eletrolítica. Medindo-se os volumes dos gases gerados foi possível também
averiguar a composição química da água e relacionar com a lei das proporções
definidas de Proust (CHANG, p. 29, 2006). A confecção da célula eletrolítica
com materiais de fácil acesso e a geração dos gases hidrogênio e oxigênio a
partir da eletrólise da água, podem facilitar a compreensão dos conceitos
relacionados com a eletroquímica. O experimento cria oportunidades para
abordar as necessidades energéticas da sociedade moderna, a qualidade de
vida e questões relacionadas com a preservação ambiental
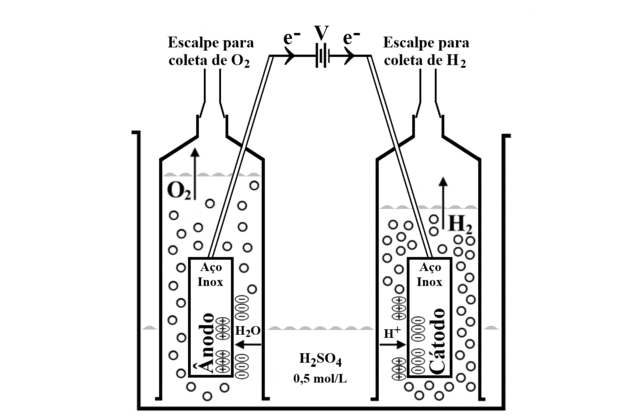
Figura 1. Esquema simplificado da célula eletrolítica mostrando o desprendimento dos gases hidrogênio e oxigênio
Conclusões
A visibilidade do desprendimento dos gases hidrogênio e oxigênio e a alteração na cor da solução eletrolítica direcionam os alunos para as interpretações das reações envolvidas na decomposição da água. Considerando a inversão das reações, oxidação do hidrogênio e redução do oxigênio, conduz o aluno a relacionar com o potencial energético armazenado no hidrogênio. A experimentação ultrapassa os limites específicos do conhecimento sobre eletroquímica, o aluno desempenha papel ativo no processo ensino-aprendizagem, habilitando-o para a compreensão dos fenômenos químicos em escala microscópica
Agradecimentos
Financiamento 001 (Portaria 206 da CAPES, 04/09/2018). RQ-MG/FAPEMIG (REDE-113/10; CEX-RED-00010-14). E.E. Prof. Antônio da Silva (Carneirinho/MG) e E.E. Dom Pedro II (União de Minas/MG)
Referências
CHANG, R. Química Geral. São Paulo, McGraw-Hill, 2006. Cap. 2. PEIXOTO, E.M.A. Elemento Químico: Hidrogênio e Hélio. Química Nova na Escola, n° 1, 1995. TICIANELLI, E.A.; GONZALEZ, E.R. Eletroquímica: Princípios e Aplicações. São Paulo, Edusp, 1998. Cap. 5.

