Autores
Andrade, M.S.F. (UFES/CEUNES) ; Schettino, M.E.P.G.O. (E.E.E.F.M. NESTOR GOMES) ; Mendes, A.N.F. (UFES/CEUNES) ; Rocha, S.M.S. (UFES/CEUNES)
Resumo
O presente trabalho visa à divulgação da construção de um aparato de titulação alternativo, com materiais de baixo custo e fácil acesso, para o estudo da volumetria no ensino médio. O aparato tradicional utilizado nos laboratórios de química foi substituído por placas de madeira, barra de ferro, mangueira transparente, fita métrica, copos de requeijão, garrafa PET, seringa, equipo de soro cirúrgico, fios transparentes e funil de plástico. Para avaliar a viabilidade do aparato, foi feita a prática de determinação do teor de ácido acético no vinagre em uma turma de 2º ano do Ensino Médio da E.E.E.F.M. Nestor Gomes, em São Mateus/ES, utilizando-se solução de soda cáustica comercial, vinagre comercial 4,0% e indicador de repolho roxo. O resultado experimental foi de 4,2%.
Palavras chaves
Aparato alternativo; Volumetria; Ensino médio
Introdução
A experimentação no ensino de química é tema constante nas salas de aulas, nas conversas entre professores da disciplina, em congressos e em revistas da área, seja por sua contribuição para o processo de ensino e aprendizagem ou pelas dificuldades encontradas para sua aplicação e desenvolvimento (SANTANA, 2014). Porém, mesmo após a publicação de vários documentos do Ministério e Secretarias de Educação, como LDB, PCNEM e CBC, persiste um número enorme de conteúdos na maioria dos livros didáticos, com detalhamentos desnecessários e anacrônicos, e muitos professores acabam optando pela eliminação de aulas práticas [...], que pode resultar em uma aprendizagem pouco duradoura, mais mecânica que significativa. Essa situação não permite ao aluno participar da construção de um entendimento mais profundo e útil sobre o mundo natural e cultural, como preconiza a LDB (RUBINGER; BRAATHEN, 2012). Segundo Rubinger e Braathen (p. 11, 2012), o ponto fundamental é que a química é uma ciência experimental, portanto, um curso de química sem experimentos não faz sentido para a maioria dos estudantes. Embora seja reconhecida a importância da utilização da experimentação e a maneira de desenvolvê-las nas aulas de química, muitos professores atribuem dificuldades para sua elaboração e execução no cotidiano das salas de aula. Ausência de laboratório e materiais (vidrarias e reagentes) nas escolas; ausência de técnico laboratorista, falta de tempo para planejar e executar as atividades; excesso de conteúdos teóricos a serem ministrados; falta de acesso a materiais de apoio, são as principais dificuldades citados pelos professores para justificarem a não utilização de atividades experimentais em suas aulas (SANTANA, 2014). Driblar tais dificuldades é de grande importância para que se possa retirar o “rótulo de que a química é uma matéria difícil”, pois o desenvolvimento das aulas práticas não está vinculado exclusivamente ao laboratório, assim como desenvolver um experimento que seja sofisticado não irá garantir que o aluno consiga aprender tudo o que ele precisa. Existem algumas aulas práticas que podem ser realizadas em sala, com materiais de baixo custo adquiridos em farmácias, supermercados, casas de materiais para construção etc. Para que essas aulas práticas possam acontecer, o professor precisa apresentar motivação, planejamento e conhecimento. Com isso pode-se despertar nos alunos um maior interesse em aprender química, pois eles estarão exercitando o raciocínio, manipulando e criando seus próprios experimentos (CASTELEINS, 2011). Com situações simples do cotidiano dos alunos, os professores podem, em primeiro momento, conhecer as concepções que os alunos trazem sobre o assunto e colocá-las em discussão, de forma que, com o desenvolvimento do conteúdo e do experimento, os alunos consigam propor uma solução para o problema investigado (SANTANA, 2014). Então, um experimento simples pode ser transformado em uma atividade investigativa se o professor conseguir inserir outras atividades que contemplem generalizações e previsões (SANTOS; MALDANER, 2011). A experimentação é um recurso pedagógico que contempla diversas habilidades, principalmente as cognitivas. Mas, muitos professores ainda as utilizam de maneira inadequada, desvalorizando seus aspectos cognitivos e privilegiando, muitas vezes, somente seu caráter motivador, podendo desenvolver no aluno uma visão distorcida sobre a função da experimentação e da construção do conhecimento científico (HODSON, apud SANTANA, p. 71, 2014). Práticas tradicionais ainda são muito vistas nas salas de aulas de química na educação básica. Tais atividades são, geralmente, realizadas de forma isolada do contexto de ensino, utilizadas após o desenvolvimento de determinado conteúdo em sala de aula, a fim de que o aluno verifique ou comprove o que foi discutido (CACHAPUZ, apud SANTANA, p. 72, 2014), com pouca ou nenhuma discussão sobre os dados e resultados obtidos (SANTANA, 2014). Os experimentos não podem ser meras ilustrações de teorias já explicitadas pelo professor ou pelo livro didático. Assim, em cada experimento, o professor deve dar espaço aos alunos para exporem e discutirem suas opiniões, sendo uma espécie de mediador do debate das ideias do grupo (RUBINGER; BRAATHEN, 2012). É importante mencionar que, mesmo tendo um laboratório bem equipado, mesclar o alternativo com o tecnológico e moderno pode resultar em um programa de estudos bastante atraente para a faixa etária do ensino médio, com resultados positivos em termos de aprendizagem (RUBINGER; BRAATHEN, 2012). O aparato de titulação alternativo foi construído com o objetivo de auxiliar o professor no ensino contextualizado dos princípios da análise volumétrica e dos conceitos envolvidos, como ácido, base, reações de neutralização, pH, através da promoção de um ambiente de observação, discussão, debate e elaboração de hipóteses, desenvolvendo o raciocínio lógico e pensamento crítico nos alunos para a apreensão do conhecimento químico.
Material e métodos
ADAPTAÇÃO DOS MATERIAIS ALTERNATIVOS: O aparato alternativo para realização de análise volumétrica foi confeccionado com materiais que seriam descartados ou de baixo custo e fácil acesso em substituição àqueles usualmente utilizados em laboratório de química. Para a construção do suporte universal foi utilizada uma placa de madeira MDF, encontrada em marcenarias, e uma barra de ferro; a base do suporte foi confeccionada com a madeira MDF e a haste foi feita com uma parte de madeira MDF acoplada à barra de ferro com pregos e roscas. A bureta alternativa foi confeccionada com uma mangueira flexível de material transparente com aproximadamente dois centímetros de diâmetro, encontrada em casas de material de construção. Para a leitura do volume da bureta foi adaptada uma fita métrica à haste do suporte universal alternativo. Como regulador de vazão utilizou-se um equipo de soro tipo cirúrgico, comprado em loja de material hospitalar, que tem a função de controlar o gotejamento da solução titulante. As garras, que mantém a bureta fixa à haste no suporte universal foram substituídas por fios transparentes. Como erlenmeyers e béqueres alternativos foram utilizados copos de requeijão de plástico. Os balões volumétricos para o preparo das soluções foram substituídos por garrafas PET transparentes de 500 mL. A pipeta graduada, que seria utilizada para transferir a alíquota da solução titulada para o erlenmeyer, foi substituída por uma seringa de 10 mL. Foi utilizado um funil de plástico para auxiliar na transferência do titulante para a bureta. CALIBRAÇÃO DOS MATERIAIS ALTERNATIVOS: A bureta alternativa foi calibrada através da adição do volume total da seringa de 10 mL na bureta, verificando-se a graduação na fita métrica ao adicionar a água; a relação do volume medido (mL) com o comprimento da fita métrica (cm) foi determinada por cálculos de regra de três simples. Para a calibração dos balões volumétricos alternativos foi aplicado o método padrão de calibração (pesagem de massas de água) usando a densidade da água na temperatura de trabalho, com a possibilidade de visualização do menisco no “pescoço” da garrafa PET. Os erlenmeyers alternativos não foram calibrados, e o volume médio foi determinado com base no rótulo das embalagens. TITULAÇÃO ÁCIDO- BASE: Para a avaliação da viabilidade do aparato alternativo na análise volumétrica, foi feita a determinação do teor de ácido acético em uma amostra de vinagre com os alunos de 2º ano do ensino médio da E.E.E.F.M. Nestor Gomes, em São Mateus/ES. Os reagentes utilizados foram são facilmente encontrados no supermercado. Como titulante utilizou-se uma solução de soda cáustica (NaOH impuro) de concentração aproximada 0,1 mol/L; o titulado foi uma amostra de vinagre comercial 4,0%; e o indicador ácido-base foi feito com extrato de repolho roxo. Foi feito um diagnóstico inicial para avaliar os conhecimentos prévios dos alunos e uma posterior análise dos benefícios da aula prática.
Resultado e discussão
ADAPTAÇÃO DOS MATERIAIS ALTERNATIVOS: Os materiais alternativos foram
escolhidos, além da acessibilidade e custo, com base na aparência, de modo
que o aparato ficasse visualmente semelhante ao aparato tradicional, como
pode ser visualizado na Figura 1. CALIBRAÇÃO DOS MATERIAIS ALTERNATIVOS: A
adição do volume total da seringa de 10 mL na bureta foi equivalente a
aproximadamente 3,7 centímetros medidos na fita métrica, após teste em
triplicata. A relação de um centímetro de comprimento da fita com o volume,
em mililitros, foi determinada por regra de três simples. A relação entre o
comprimento e o volume estabelecida para a leitura do volume gasto de
titulante na bureta alternativa foi determinada como 1 cm=2,7 mL (Eq. 1).
Para a calibração das garrafas PET de 500 mL, utilizadas como balões
volumétricos alternativos, foram feitas as pesagens em triplicata das duas
garrafas, vazias e com água destilada, e determinada a massa de água por
diferença. A temperatura da água foi medida em T = 26 °C, e a densidade foi
determinada em ρ = 0,9968 g/mL. Através da relação de massa, volume e
densidade ρ=m/V (Eq. 2) foram determinados os volumes de água contidos nas
garrafas 1 e 2 como V=499 mL. Segundo os cálculos, as garrafas PET
utilizadas como balões volumétricos alternativos possuem um volume
tecnicamente igual aquele descrito no rótulo (500 mL). Assim, o menisco do
balão utilizado foi determinado em 500 mL onde ambas as garrafas possuíam
marca aparente. TITULAÇÃO ÁCIDO-BASE: Para a realização da prática de
determinação do teor de ácido acético em uma amostra de vinagre, foram
preparadas soluções de hidróxido de sódio de aproximadamente M≅0,1 mol/L,
utilizando a soda cáustica (NaOH impuro), utilizando-se o balões
volumétricos alternativos de 500 mL. Não foi feita a padronização das
soluções de soda cáustica considerando-se que o experimento seria voltado
para fins didáticos, não sendo necessária a determinação precisa da
concentração das soluções, desde que os resultados fossem compatíveis com
dados teóricos. O extrato de repolho roxo, utilizado como indicador ácido-
base, foi obtido após serem fervidas algumas folhas de repolho com água. A
marca do vinagre comercial 4,0% foi escolhida arbitrariamente. Procedeu-se
com a titulação de uma alíquota de 2 mL de vinagre, diluída com 25 mL de
água, empregando-se como titulante a solução de soda cáustica. A quantidade
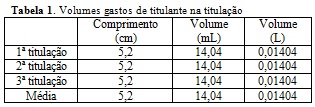
de titulante gasto, em triplicata, foi primeiramente obtida em comprimento
(cm) e, então, convertida para volume (mL) pela Eq. 1. Os resultados estão
descritos na Tabela 1. A reação química entre o hidróxido de sódio
(titulante) e o ácido acético contido no vinagre (titulado) obedece à Reação
1.
NaOH(aq) + CH3COOH(aq) CH3COONa(aq) + H2O(aq) (Reação 1)
Com o volume (V) de titulante gasto na titulação e a molaridade da solução
de hidróxido de sódio (M) foi possível determinar o número de mol de
hidróxido de sódio (n1) gasto na reação, utilizando a Equação 3.
n1=M.V=0,1mol/L.0,01404L=0,001404 mol de NaOH (Eq.3)
Segundo a Reação 1, a estequiometria entre os reagentes é de 1:1, ou seja,
para cada mol de hidróxido de sódio adicionado ao erlenmeyer alternativo, 1
mol de ácido acético é consumido. Com isso, foi possível determinar o número
de mol de ácido acético (n2) consumido na reação (Equação 4).
n2=n1=0,001404 mol de CH3COOH (Eq.4)
Sabendo-se o número de mol de titulado consumido, foi possível determinar a
massa do titulado (m), com base na massa molar (MM) do ácido acético
(Equação 5).
m=MM.n2=60g/mol.0,001404 mol=0,08424g de CH3COOH (Eq.5)
Finalmente, com a massa (m) do titulado, determinou-se o teor de ácido
acético presente na alíquota de 2 mL de vinagre, segundo a Equação 6.
Teor (g/100mL)=(m .100)/V(alíquota)=(0,08424g .100mL)/(2 mL)=4,2 g=4,2%
(Eq.6)
O teor de ácido acético determinado pela análise volumétrica com o aparato
alternativo ficou bem próximo ao valor descrito no rótulo do produto (4,0%),
comprovando assim a viabilidade do aparato alternativo na prática de
titulação para fins didáticos.
A proposta da realização da experimentação foi fazer um diagnóstico inicial,
ou seja, conhecer como os educandos se manifestam frente a uma atividade
diferenciada, e quais as vantagens da metodologia. Os alunos, por não terem
acesso a um laboratório didático, ficaram entusiasmados com a aula prática,
se envolveram e demostraram interesse em aprender os novos conceitos
explanados durante a aula. Assim, foi possível estabelecer um ambiente de
debates e discussões durante a experimentação, no qual os próprios alunos
propuseram hipóteses para os fenômenos e sugeriram novas práticas. Os alunos
puderam desenvolver o raciocínio lógico e o pensamento crítico, o que
auxilia na formação de cidadãos mais conscientes e críticos da sua
realidade, pois formar para a cidadania deve ser o princípio da educação
básica brasileira, e o ensino de ciências não deve valorizar o acúmulo de
informações, mas sim a criatividade, nas atividades práticas experimentais,
nas atividades lúdicas, nas discussões de textos, nas resoluções de
problemas, pois, pensar ciências relaciona-se, diretamente, com a formação
de pessoas que possam participar ativamente dessa sociedade (SANTANA,2014).

Aparato de titulação alternativo
Volumes gastos de titulante na titulação
Conclusões
O aparato alternativo apresentou-se visualmente semelhante ao aparato tradicional e eficiente na realização da titulação ácido-base do NaOH com CH3COOH, com teor experimental de 4,2% de ácido acético no vinagre, valor bem próximo ao teor de 4,0% descrito no rótulo do produto. Os materiais utilizados são facilmente encontrados no comércio local e podem ser substituídos por outros materiais. O aparato é de fácil construção, o que permite que os alunos confeccionem e manipulem seus próprios aparatos titulométricos. O diagnóstico inicial indicou que os educandos não conheciam os conceitos de análise titulométrica e a maioria não sabia explicar os conceitos químicos envolvidos. A prática experimental permitiu que os alunos conhecessem as etapas e os cálculos envolvidos na técnica de análise volumétrica, além de diversos conteúdos de ciências e química, como ácido, base, reação de neutralização, pH etc. A proposta visou colocar os educandos diante da realidade da experimentação, com a utilização de uma técnica comum nos laboratórios químicos, permitindo que os próprios alunos investigassem a prática e descobrissem outros conceitos envolvidos por trás da técnica de análise volumétrica. Houve a participação ativa dos educandos, e a interação dos alunos entre si e com a professora em sala. A professora atuou como mediadora das atividades e propôs os desafios; o os alunos realizaram as atividades, participando dos debates e questionando a educadora durante todo o processo. Após a prática, a professora verificou uma aquisição/ampliação de conhecimentos que permitiram um melhor entendimento dos conteúdos de química pelos discentes, comprovando que o processo de aprendizagem em nada foi prejudicado em função do uso de um aparato alternativo. Além disso, o uso de materiais recicláveis para a construção de um aparato titulométrico trouxe aos alunos a consciência ambiental, a preocupação com a produção de lixo e a reutilização do que seria descartado.
Agradecimentos
Aos alunos da E.E.E.F.M. Nestor Gomes que participaram da pesquisa.
Referências
CASTELEINS, V. L. Dificuldades e benefícios que o docente encontra ao realizar aulas práticas de química. In: CONGRESSO NACIONAL DE EDUCAÇÃO – EDUCERE, 10., 2011, Curitiba. Anais eletrônicos... Disponível em: <http://educere.bruc.com.br/CD2011/pdf/6331_3949.pdf>. Acesso em: 27 maio 2015.
RUBINGER, M. M. M.; BRAATHEN, P. C. Ação e reação: ideias para aulas especiais de química. Belo Horizonte: RHJ, 2012.
SANTANA, E.; SILVA, E. (Org.). Tópicos em Ensino de Química. São Carlos: Pedro & João Editores, 2014.
SANTOS, W. L. P.; MALDANER, O. A. (Orgs.). Ensino de química em foco. Ijuí: Unijuí, 2011.

